- +1
【学术前沿】周斌团队开发谱系示踪新技术揭示胰岛beta细胞来源
胰岛beta细胞可以分泌胰岛素,具有降低血糖的功能,胰岛素和胰岛alpha细胞分泌的胰高血糖素协同作用维持体内血糖稳态。糖尿病是一种以高血糖为主要病征的代谢性疾病,具有很多并发症,包括心脏病发作、中风、肾衰竭、失明和截肢等,已成为严重威胁人类健康的一大杀手,造成了巨大的医疗负担。糖尿病主要包括I型和II型两种,I型主要由于患者本身的免疫系统缺陷引起的beta细胞选择性破坏,表现为胰岛素缺乏引起的多食多饮多尿,血糖水平升高等。II型糖尿病占总糖尿病患者90%以上,与遗传、肥胖和缺乏运动等诸多因素有关,多为中年以后发病,相关研究发现该类患者体内胰岛仍有产生胰岛素的能力,但beta细胞数量显著少于健康个体,胰岛素处于一种缺乏状态。因此,阐明胰岛beta细胞在体内稳态和不同病理状态下来源,可以为糖尿病的临床治疗提供新的研究方向,具有重要科学意义。
北京时间3月16日,国际学术期刊Nature Metabolism在线发表了中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周斌研究组的研究成果“Pre-existing beta cells but not progenitors contribute to new beta cells in the adult pancreas”。该研究开发了能够同时示踪胰岛beta细胞和非beta细胞的双同源重组介导的谱系示踪新技术,利用该技术研究人员揭示了成体胰岛beta细胞的来源,发现在正常稳态及组织损伤情况下成体胰岛beta细胞来源于自我增殖,而非干细胞分化。该研究为糖尿病临床治疗研究提供了重要的理论基础和研究新思路。

成体哺乳动物胰岛中beta细胞的来源目前仍有较大争议,主要报道了两种不同的机制:胰岛 beta细胞的自我复制和由非beta细胞生成新的beta细胞(称为新生)。关于第一种机制,不同研究组利用遗传谱系示踪技术证明了beta细胞自我复制是哺乳动物出生后以及不同损伤条件下产生新beta细胞的主要手段【1-5】。第二种机制则认为beta可能是通过分化的非beta细胞转分化或通过胰岛干细胞或祖细胞的分化而产生的【6-14】。
周斌研究组长期致力于新型遗传谱系示踪技术的开发与应用,在该项研究中,他们建立了一种可以同时标记胰岛beta细胞和非beta细胞的新型双同源重组介导的谱系示踪新系统(图1a)。基于课题组前期开发的Dre-rox和Cre-loxP的双同源重组酶介导的遗传谱系示踪技术(He et al., Nature Medicine 2017)【15】基础上,研究人员突破以往研究模式,不再依赖单一分子标记追踪某一群细胞分化情况,而是同时且不可逆地区分标记所有beta细胞和其他可能含有潜在干细胞的所有非beta细胞。研究人员使用实验室构建的正交位点特异性双同源重组系统Cre-loxP和Dre-rox的交叉型报告小鼠IR1。在IR1报告小鼠中,两对重组识别位点(rox和loxP)交错排列,这样,一次成功的重组可以诱导表达一种遗传报告基因,并且还阻止了另一次重组的发生。研究人员设计与构建了Ins2-Dre用于标记和占位所有的胰岛beta细胞, beta细胞中的Dre-rox重组首先从IR1中删除了包含一个loxP位点和ZsGreen的rox片段,因此该等位基因随后表达tdTomato并且不再对Cre-loxP重组有反应。同样,使用实验室之前验证过的诱导型Cre系统R26-iCre标记非beta细胞,该系统由R26-rtTA和TRE-Cre等位基因组成(图1b),在该系统中,四环霉素(Dox)介导的rtTA与TRE结合导致Cre表达,非beta细胞中的Cre-loxP重组可去除loxP片段,去除的片段包含一个rox位点和转录终止序列,从而阻止Dre-rox介导的重组,即使该非beta细胞(例如干细胞)分化为产生胰岛素的beta细胞,新产生的beta细胞也将表达ZsGreen而不是tdTomato。该设计可以用两个不同的永久遗传标记同时区分标记beta细胞和非beta细胞:tdTomato和ZsGreen。
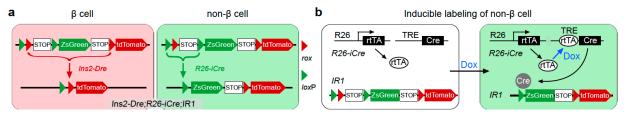
图1
研究人员首先利用该系统研究了在成体胰腺生理稳态过程中beta细胞的来源,在6周龄大的Ins2-Dre;R26-iCre;IR1小鼠上诱导Dox1周,然后在3或6个月后分析胰腺组织(图2a),组织荧光检测可以看到整个胰腺组织标记为ZsGreen,中间夹杂着tdTomato阳性信号(图2b)。通过切片染色发现胰岛 beta细胞仍标记为tdTomato,没有发现ZsGreen阳性的beta细胞(图2c,d),说明在生理稳态条件下,beta细胞主要来自于已有beta细胞的自我复制。
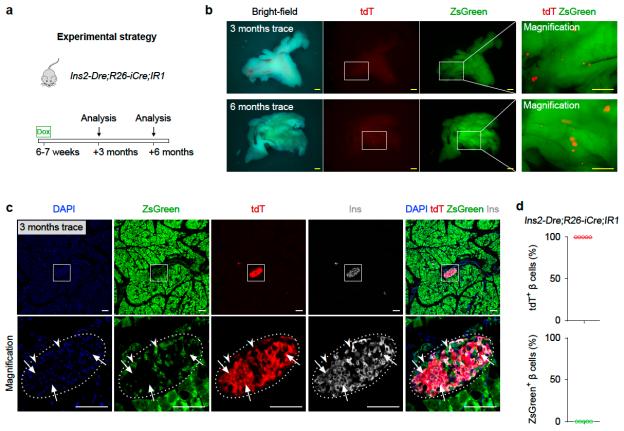
图2
研究人员还构建了胰腺部分切除(partial pancreatectomy, PPX)和妊娠(pregnancy)介导的胰岛beta细胞再生模型、胰腺导管结扎(pancreatic duct ligation, PDL)模型、链脲佐霉素(streptozotocin, STZ)介导的糖尿病模型等,在这些非遗传操作损伤模型中均没有发现ZsGreen阳性的细胞表达Insulin。此外,还构建了新的白喉毒素介导的细胞清除小鼠IR1-DTR,对Ins2-Dre;R26-iCre;IR1-DTR小鼠注射白喉毒素,研究人员发现在清除绝大部分beta细胞(>99%)的情况下,恢复一段时间后可以找到少量ZsGreen阳性的细胞表达Insulin,说明即使非beta细胞贡献少量Insulin阳性细胞,该系统也可以捕捉到的,证明了系统的有效性。
Ins2-Dre作为一种持续性重组酶,可能会意外地标记非常罕见的假定干细胞,这些干细胞可能瞬时表达过Insulin。为了避免这种可能存在的情况,周斌组建立了一种可诱导性饱和示踪的方法(Lineage Tracing at Saturation)。研究人员构建了新的特异性诱导型Ins2-DreER基因敲入小鼠品系和靶向Hipp11(H11)基因座的报告基因工具小鼠H11-rox-tdTomato(图3a)。在成体阶段通过他莫昔芬诱导beta细胞进行遗传标记( tdTomato),那么其他非beta细胞为tdTomato阴性(图3b)。在一段时间之后,如果有tdTomato阴性的非beta贡献产生新的beta细胞,它们将表达Insulin,因为此时已经没有他莫昔芬发挥作用而不会被tdTomato标记上。该策略的精确度很大程度上取决于beta细胞诱导标记效率。如果beta细胞标记的饱和度非常接近100%(比如99.9%),当tdTomato阴性的beta细胞的百分比显著增加(超过0.1%),则可以解释为新的beta细胞产生于干细胞。研究人员在Ins-DreER; H11-rox-tdTomato成年小鼠注射他莫昔芬1周(+ 1W)之后分析组织样本(图3c),发现该小鼠具有非常高的beta细胞标记效率(图3d),并且这些tdTomato 阳性细胞仅是Insulin 阳性的beta细胞而不是胰岛中其他类型内分泌细胞,证明了该系统的特异性。研究人员利用这个高效且特异的可诱导型beta细胞示踪系统研究了不同生理病理条件下beta细胞来源,再次证实beta细胞主要来源于已有beta细胞的自我复制。
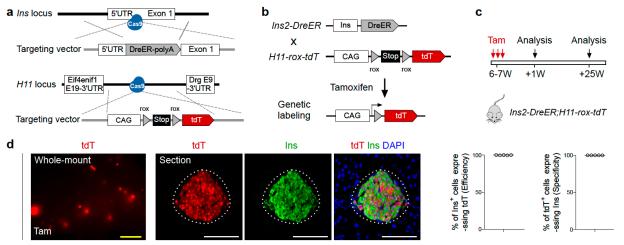
图3
综上,该研究的亮点在于开发了一种双同源重组酶介导的谱系示踪新技术来研究成体胰岛beta细胞来源。突破了传统思维模式和技术局限性,可以不依赖于beta细胞干细胞或祖细胞的特定标记,同时且不可逆地区分标记胰岛beta细胞和非beta细胞,发现不同生理及损伤状态下,成体beta细胞产生主要来源于自我复制,而非干细胞分化(图4)。新构建的一系列遗传工具小鼠可以为胰岛beta细胞及其他组织器官发育、疾病、再生等研究提供了强大的技术支持,该研究成果可以为糖尿病临床治疗提供重要理论基础和新的研究方向。
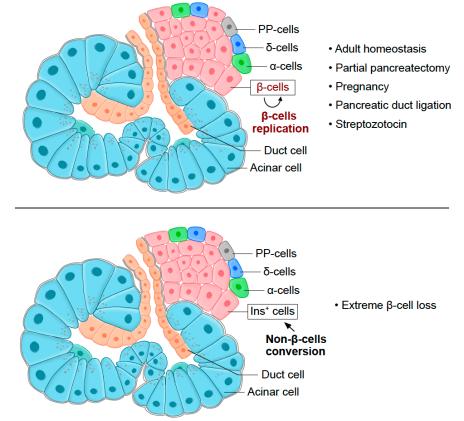
图4
中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周斌研究组博士后赵欢博士为该论文第一作者,周斌研究员为该论文通讯作者。该工作得到了康奈尔大学威尔·康奈尔医学院的Qiao Zhou教授、香港中文大学Kathy O. Lui教授的大力支持。该工作也得到分子细胞科学卓越创新中心动物平台和和细胞分析技术平台的大力支持,并得到来自中科院、基金委、科技部以及上海市科委等部门的经费支持。
原文链接
https://doi.org/10.1038/s42255-021-00364-0
参考文献
1. Dor Y, Brown J, Martinez OI and Melton DA. Adult pancreatic beta-cells are formed by self-duplication rather than stem-cell differentiation. Nature. 2004;429:41-46.
2. Solar M, Cardalda C, Houbracken I, Martin M, Maestro MA, De Medts N, Xu X, Grau V, Heimberg H, Bouwens L and Ferrer J. Pancreatic exocrine duct cells give rise to insulin-producing beta cells during embryogenesis but not after birth. Dev Cell. 2009;17:849-60.
3. Kopinke D and Murtaugh LC. Exocrine-to-endocrine differentiation is detectable only prior to birth in the uninjured mouse pancreas. Bmc Dev Biol. 2010;10.
4. Kopp JL, Dubois CL, Schaffer AE, Hao EG, Shih HP, Seymour PA, Ma JN and Sander M. Sox9(+) ductal cells are multipotent progenitors throughout development but do not produce new endocrine cells in the normal or injured adult pancreas. Development. 2011;138:653-665.
5. Xiao X, Chen Z, Shiota C, Prasadan K, Guo P, El-Gohary Y, Paredes J, Welsh C, Wiersch J and Gittes GK. No evidence for beta cell neogenesis in murine adult pancreas. J Clin Invest. 2013;123:2207-17.
6. Xu X, D'Hoker J, Stange G, Bonne S, De Leu N, Xiao X, Van de Casteele M, Mellitzer G, Ling Z, Pipeleers D, Bouwens L, Scharfmann R, Gradwohl G and Heimberg H. Beta cells can be generated from endogenous progenitors in injured adult mouse pancreas. Cell. 2008;132:197-207.
7. Inada A, Nienaber C, Katsuta H, Fujitani Y, Levine J, Morita R, Sharma A and Bonner-Weir S. Carbonic anhydrase II-positive pancreatic cells are progenitors for both endocrine and exocrine pancreas after birth. Proc Natl Acad Sci U S A. 2008;105:19915-9.
8. Pan FC, Bankaitis ED, Boyer D, Xu X, Van de Casteele M, Magnuson MA, Heimberg H and Wright CV. Spatiotemporal patterns of multipotentiality in Ptf1a-expressing cells during pancreas organogenesis and injury-induced facultative restoration. Development. 2013;140:751-64.
9. Jin L, Gao D, Feng T, Tremblay JR, Ghazalli N, Luo A, Rawson J, Quijano JC, Chai J, Wedeken L, Hsu J, LeBon J, Walker S, Shih HP, Mahdavi A, Tirrell DA, Riggs AD and Ku HT. Cells with surface expression of CD133highCD71low are enriched for tripotent colony-forming progenitor cells in the adult murine pancreas. Stem Cell Res. 2016;16:40-53.
10. Rovira M, Scott SG, Liss AS, Jensen J, Thayer SP and Leach SD. Isolation and characterization of centroacinar/terminal ductal progenitor cells in adult mouse pancreas. Proc Natl Acad Sci U S A. 2010;107:75-80.
11. Criscimanna A, Speicher JA, Houshmand G, Shiota C, Prasadan K, Ji B, Logsdon CD, Gittes GK and Esni F. Duct cells contribute to regeneration of endocrine and acinar cells following pancreatic damage in adult mice. Gastroenterology. 2011;141:1451-62, 1462 e1-6.
12. Wang D, Wang J, Bai L, Pan H, Feng H, Clevers H and Zeng YA. Long-Term Expansion of Pancreatic Islet Organoids from Resident Procr(+) Progenitors. Cell. 2020;180:1198-1211 e19.
13. Thorel F, Nepote V, Avril I, Kohno K, Desgraz R, Chera S and Herrera PL. Conversion of adult pancreatic alpha-cells to beta-cells after extreme beta-cell loss. Nature. 2010;464:1149-54.
14. Chera S, Baronnier D, Ghila L, Cigliola V, Jensen JN, Gu G, Furuyama K, Thorel F, Gribble FM, Reimann F and Herrera PL. Diabetes recovery by age-dependent conversion of pancreatic delta-cells into insulin producers. Nature. 2014;514:503-7.
15. He L, Li Y, Li Y, Pu W, Huang X, Tian X, Wang Y, Zhang H, Liu Q, Zhang L, Zhao H, Tang J, Ji H, Cai D, Han Z, Han Z, Nie Y, Hu S, Wang QD, Sun R, Fei J, Wang F, Chen T, Yan Y, Huang H, Pu WT and Zhou B. Enhancing the precision of genetic lineage tracing using dual recombinases. Nat Med. 2017;23:1488-1498.
原标题:《【学术前沿】周斌团队开发谱系示踪新技术揭示胰岛beta细胞来源》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




