- +1
中国科学家合作揭示造血干细胞异质性与骨髓增殖性肿瘤的临床相关性
原创 Cell Press CellPress细胞科学

生命科学
Life science
2021年2月22日,中国医学科学院血液病医院(中国医学科学院血液学研究所)石莉红/张磊/程涛教授团队联合南方医科大学王栋团队在Cell Press细胞出版社旗下期刊Cell Stem Cell上发表了一篇新研究,题为"Hematopoietic stem cell heterogeneity is linked to the initiation and therapeutic response of myeloproliferative neoplasms",研究团队从单细胞角度解析了造血干细胞异质性与血液肿瘤发病与治疗的关联,指出肿瘤突变发生的造血干细胞异质性亚群是导致不同血液肿瘤发生的原因之一。
Cell Press细胞出版社微信公众号对该论文作者团队进行了采访并对论文进行了解读,旨在与广大科研人员深入分享该研究成果以及一些未来的展望,点击“阅读原文”或识别下图二维码阅读英文原文。
长按图片识别二维码阅读原文
研究简介
尽管干细胞异质性已经在多种组织中被发现,也是当前生物学研究的一个热点,但其对于恶性疾病,特别是肿瘤发生的致病机理中的意义尚未明确。JAK2V617F阳性的骨髓增殖性肿瘤(MPN)是一组造血干细胞起源的疾病,其造血干细胞携带同一JAK2V617F突变,但可表现出不同的疾病表型,包括真性红细胞增多症(PV)、原发性血小板增多症(ET)和原发性骨髓纤维化。研究团队利用单细胞转录组表达谱分析联合单细胞突变检测的手段,发现在初诊JAK2V617F+ 原发性血小板增多症患者中,由JAK2突变驱动、具有巨核细胞(Mk)分化偏好的造血干细胞亚群比例显著扩大,并具有增强的增殖和巨核分化潜能,这些突变的细胞中具有增强的干扰素信号,并表现出对干扰素信号刺激的高敏性。而在JAK2V617F+ 原发性血小板增多症患者的治疗期间,巨核谱系偏好的造血干细胞亚群比例降低。有趣的是,纯合突变造血干细胞表现出静息和休眠的特征,而杂合突变造血干细胞则表现出凋亡的特征。这项研究从临床样本层面出发,不仅为造血干细胞异质性与恶性血液疾病的发病机理和治疗反应之间的联系提供了重要的证据,也提示我们干细胞异质性可能和肿瘤的复发、难治和耐药有一定的关联。
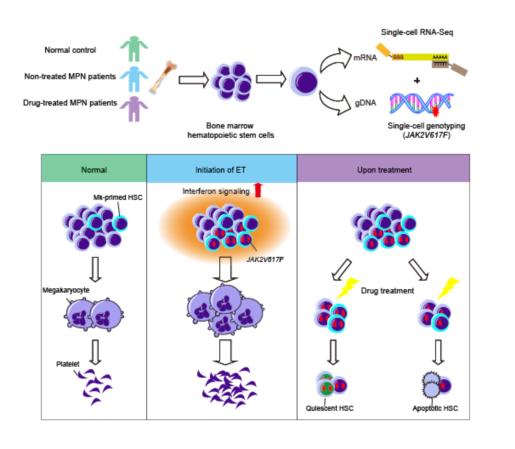
主要发现
1. 原发性血小板增多症患者中JAK2突变的造血干细胞表现出增强的巨核细胞谱系偏好性。研究者首先通过对初诊的不同骨髓增殖性肿瘤亚型患者(JAK2V617F+ 原发性血小板增多症、真性红细胞增多症)和正常对照的造血干细胞进行高通量转录组测序,发现初诊原发性血小板增多症患者的造血干细胞具有明显的巨核谱系偏向特征,而真性红细胞增多症患者的造血干细胞并未表现出明显的谱系偏好性。进一步利用单细胞转录组联合单细胞突变检测分析发现初诊原发性血小板增多症患者中JAK2突变的造血干细胞不仅巨核偏好特征增强,该亚群比例也明显扩大,提示JAK2突变后,巨核偏好造血干细胞比例扩大和巨核分化潜能增强可能是导致原发性血小板增多症患者临床症状的重要原因。该结果证实了造血干细胞异质性与骨髓增殖性肿瘤具有密切的相关性。
2. 原发性血小板增多症患者中JAK2突变的造血干细胞对干扰素信号具有高敏性。基于上述发现,研究者进一步阐明了导致原发性血小板增多症患者中JAK2突变的造血干细胞巨核细胞谱系偏好性的潜在微环境因素之一,即干扰素信号升高。本研究发现JAK2V617F+ 初诊原发性血小板增多症患者中突变的巨核偏好造血干细胞对干扰素刺激(短时间低浓度)具有高敏性,在其刺激下更容易增殖和向巨核谱系分化,从而促进了原发性血小板增多症的发生。该结果提示炎症信号在骨髓增殖性肿瘤发病中扮演着重要角色,未来联合抗炎药物有望成为治疗骨髓增殖性肿瘤的新策略。
3. 经过治疗的原发性血小板增多症患者,其JAK2突变的造血干细胞在转录组水平展现出不同的特征。在既往骨髓增殖性肿瘤小鼠研究中,干扰素-α被报道可以通过促进JAK2突变的造血干细胞凋亡或促进其增殖以达到造血干细胞耗竭的效果来达到降低突变负荷的治疗效果[1, 2]。研究者对经干扰素单独或者联合羟基脲治疗的原发性血小板增多患者的分析提示:治疗后纯合突变造血干细胞表现出静息休眠的干细胞特征,而杂合突变细胞凋亡信号增强。最终JAK2突变的巨核偏好的造血干细胞比例降低,这可能是干扰素治疗效应的机制之一。研究还提示治疗后患者中纯合突变造血干细胞的休眠状态有可能在异常的炎症微环境下被激活,为患者停药后的快速复发提供了可能,基于此,目前的一线治疗药物可能很难根除疾病,未来针对此机制联合抗炎药物的治疗手段有望彻底根除致病造血干细胞亚群从而完全治愈疾病。
小结
综上,本研究揭示了造血干细胞异质性和骨髓增殖性肿瘤在病理发生和临床治疗方面具有相关性,并在骨髓增殖性肿瘤病理机制和治疗机制方面都提供了重要发现,对临床上预防骨髓增殖性肿瘤复发或采取新的治疗策略等提供了重要启示;也为组织干细胞异质性在肿瘤发病、难治、复发等中的作用提供了新的研究方向。
作者专访
Cell Press细胞出版社特别邀请石莉红研究员代表该论文团队进行了采访,请他们为大家进一步详细解读。
CellPress:
首先请您和团队介绍一下研究初衷和起源,以及将造血干细胞异质性与骨髓增生性肿瘤联系在一起的契机?
石莉红研究员:
JAK2V617F获得性基因突变能引起骨髓造血干祖细胞及外周血中红细胞、血小板等特定谱系细胞的异常增殖,是引起费城染色体阴性的骨髓增殖性肿瘤(主要包括原发性血小板增多症、真性红细胞增多症和原发性骨髓纤维化三种疾病亚型)最常见的驱动突变。同一突变引起不同的疾病亚型这一问题一直是领域内研究的重要问题,前人的研究虽然从突变负荷、STAT通路的过度激活、其他体细胞的突变顺序和个体间遗传背景的差异等因素上与MPN疾病亚型做了关联[3-6]。但是MPN不同表型的发病机制,尤其是其与造血干细胞异质性之间的联系机制尚不完全清楚。我们通过对初诊的不同MPN亚型患者和正常对照的造血干细胞进行高通量转录组测序来比较不同亚型的MPN之间差异时,发现初诊原发性血小板增多症患者的造血干细胞高表达VWF等巨核谱系基因。考虑到VWF是巨核偏好造血干细胞的标志基因之一,而原发性血小板增多症患者的临床症状主要表现为巨核谱系的增多,我们由此将二者关联起来。
CellPress:
巨核细胞偏好的造血干细胞具有什么样的特征?如何影响MPN发病过程?
石莉红研究员:
巨核细胞偏好的造血干细胞在前人的研究中已有涉及,主要表现为造血干细胞中巨核谱系基因(VWF等)的高表达,小鼠中的实验表明,巨核谱系偏好的造血干细胞在增殖和分化过程中,更偏好向巨核细胞和血小板分化[7]。本研究中,我们发现巨核谱系潜能在原发性血小板增多症患者造血干细胞中升高。并且JAK2突变的造血干细胞,尤其是纯合突变造血干细胞,是Mk潜能增高的主要贡献者。这不仅表现在VWF、PLEK等标志基因表达的升高,同时表现在纯合突变VWF+造血干细胞亚群比例的扩大。有趣的是,与正常对照人群造血干细胞相比,原发性血小板增多症患者中的未突变造血干细胞也表达了更高水平的巨核谱系偏好基因。因此,原发性血小板增多症患者造血干细胞中巨核分化潜能的基线升高了,这意味着原发性血小板增多症患者中骨髓微环境可能有利于Mk分化和血小板生成。
CellPress:
IFN信号通路在疾病发病过程中发挥了重要作用,但临床上作为治疗药物,如何理解这种双向性?
石莉红研究员:
干扰素-α目前已被使用在MPN患者的临床治疗之中,可促进患者在临床症状、血液学及组织病理学等方面获得缓解,少数患者可达到一定程度的分子学缓解[8, 9]。对MPN小鼠模型的研究证实,IFN可通过诱导突变造血干细胞的细胞周期活跃化或通过诱导细胞凋亡来清除突变细胞[1, 2]。但是,我们的研究中,在未经过治疗的初诊原发性血小板增多症患者中,发现了上调的IFN反应基因。文献和实验验证进一步证明,炎症信号刺激(低浓度IFN刺激)能够促进巨核偏好的造血干祖细胞向巨核和血小板增殖和分化,而在临床治疗中,高浓度的IFN-α则加速了细胞的凋亡。
CellPress:
本研究中采用了单细胞分析技术来揭示造血干细胞异质性与血小板增多症之间的联系,那么单细胞分析技术具有哪些优势呢?
石莉红研究员:
近年来快速发展的单细胞测序技术,可以利用较少的生物样本、较高的测序覆盖率实现对基因表达信号的检测,在基因组、转录组、表观基因组等水平揭示肿瘤细胞的异质性,进而能够从细胞个体和肿瘤整体水平上了解单个肿瘤细胞的特征,加深对肿瘤生物学特性、遗传特性及其治疗反应的理解。本项研究采用了单细胞RNA-Seq联合单细胞genotyping的方式进行分析,该技术的优势在于能够在单一细胞内,同时获得转录组和基因组水平上特定突变类型(纯合、杂合、非突变)的信息,将骨髓增殖性肿瘤患者的突变细胞和未突变细胞与造血干细胞的特征进行更为精准的关联描述,此外还可通过比较骨髓增殖性肿瘤患者的未突变细胞和正常对照者的细胞来找到潜在的与骨髓微环境有关的致病因素,因此该单细胞技术有助于更精细化地揭示肿瘤患者中造血干细胞的异质性及其与疾病的关联。
CellPress:
不同组织中的干细胞呈现出较大的异质性,那么造血干细胞的异质性有何特点,其异质性是不是对于研究相关疾病的致病机理和优化治疗策略有所帮助呢?
石莉红研究员:
造血干细胞的异质性可以表现在特异性造血干细胞亚群方面,其中一个重要体现就是造血干细胞具有内在的谱系偏好性,例如髓系偏好的造血干细胞可倾向于向共同髓系祖细胞或巨核红系祖细胞分化,而巨核谱系偏好的造血干细胞则表现出优先向巨核谱系分化的潜能[10, 11]。造血干细胞表现出的这些异质性特征对研究血液肿瘤的致病机理以及优化治疗策略是有极大帮助的。例如可以通过研究相关疾病状态下造血干细胞亚群在基因组和转录组层面的变化,筛选出与疾病发生密切相关的关键分子、信号通路和异质性细胞亚群,获得其特异性转录表达特征,并进一步验证其在发病机制中的关键作用,此外还可针对此靶点开发早期诊断方法和特异性治疗药物,有助于未来对疾病进行早期诊断和精准化治疗。
CellPress:
本研究通过对造血干细胞异质性的研究,能够为骨髓增殖性肿瘤的致病机理或者治疗提供哪些帮助?
石莉红研究员:
首先在致病机理方面,本研究发现JAK2突变的巨核偏好的造血干细胞亚群比例扩大及巨核分化潜能增强在原发性血小板增多症的发病中扮演着重要角色。同时在既往发现的驱动突变的基础上,提出了炎症(增强的干扰素信号)在骨髓增殖性肿瘤致病机理方面的重要性。其次在治疗方面,一线治疗药物对纯合突变细胞和杂合突变细胞的不同效应——促进杂合突变细胞凋亡而维持纯合突变细胞进入休眠静息状态,这一结果为未来优化骨髓增殖性肿瘤的治疗提供了重要启示。充分利用目前靶向突变细胞的一线药物(如干扰素),并适当联合抗炎药物,或许能成为未来治疗骨髓增殖性肿瘤的新策略。
参考文献
1.Mullally, A., et al., Depletion of Jak2V617F myeloproliferative neoplasm-propagating stem cells by interferon-α in a murine model of polycythemia vera. Blood, 2013. 121(18): p. 3692-702.
2.Hasan, S., et al., JAK2V617F expression in mice amplifies early hematopoietic cells and gives them a competitive advantage that is hampered by IFNα. Blood, 2013. 122(8): p. 1464-77.
3.Li, J., et al., JAK2V617F homozygosity drives a phenotypic switch in myeloproliferative neoplasms, but is insufficient to sustain disease. Blood, 2014. 123(20): p. 3139-51.
4.Grisouard, J., et al., Deletion of Stat3 in hematopoietic cells enhances thrombocytosis and shortens survival in a JAK2-V617F mouse model of MPN. Blood, 2015. 125(13): p. 2131-40.
5.Walz, C., et al., Essential role for Stat5a/b in myeloproliferative neoplasms induced by BCR-ABL1 and JAK2(V617F) in mice. Blood, 2012. 119(15): p. 3550-60.
6.Grinfeld, J., et al., Classification and Personalized Prognosis in Myeloproliferative Neoplasms. N Engl J Med, 2018. 379(15): p. 1416-1430.
7.Sanjuan-Pla, A., et al., Platelet-biased stem cells reside at the apex of the haematopoietic stem-cell hierarchy. Nature, 2013. 502(7470): p. 232-6.
8.Hasselbalch, H.C. and M.O. Holmstrom, Perspectives on interferon-alpha in the treatment of polycythemia vera and related myeloproliferative neoplasms: minimal residual disease and cure? Semin Immunopathol, 2019. 41(1): p. 5-19.
9.Kiladjian, J.J., S. Giraudier, and B. Cassinat, Interferon-alpha for the therapy of myeloproliferative neoplasms: targeting the malignant clone. Leukemia, 2016. 30(4): p. 776-81.
10.Rodriguez-Fraticelli, A.E., et al., Clonal analysis of lineage fate in native haematopoiesis. Nature, 2018. 553: p. 212-216.
11.Yamamoto, R., et al., Clonal analysis unveils self-renewing lineage-restricted progenitors generated directly from hematopoietic stem cells. Cell, 2013. 154(5): p. 1112-26.

作者简介

石莉红
研究员
石莉红,中国医学科学院血液病医院(中国医学科学院血液学研究所)实验血液学国家重点实验室研究员、博士生导师。2008年毕业于中国科学院动物研究所,干细胞与生殖生物学国家重点实验室,获生理学博士学位,之后在美国密歇根大学医学院从事博士后研究,2014年回国并加入实验血液学国家重点实验室。研究方向主要包括:人多能干细胞(hESCs或iPSC)及造血干/祖细胞向红系定向分化的调控机制研究和红细胞疾病的发病机理研究。在Nature Medicine、Nature Communications、Blood、PNAS、Nucleic Acids Research、Bioinformatics等国际权威杂志发表SCI文章40余篇。

张磊
主任医师
张磊,中国医学科学院血液病医院(中国医学科学院血液学研究所)副所院长、国家血液系统疾病临床医学研究中心副主任、实验血液学国家重点实验室副主任、血栓止血诊疗中心副主任,以及中国医学科学院血液病基因治疗重点实验室主任和天津市基因治疗重点实验室主任,博士生导师。主要从事血栓及出血性疾病的临床诊疗及相关基础研究,擅长诊治血小板疾病和凝血因子缺陷等血液系统疾病。发表论文60余篇,SCI收录20余篇,通讯作者SCI论文9篇,多次获国家和省部级科技奖项。同时,担任第八、第九及第十届中华血液学分会血栓与止血学组委员、天津市血液学会第七届常委、WFH官方杂志Haemophilia中文版编委、中华血液学杂志通讯编委等。

程涛
教授
程涛,中国医学科学院血液病医院(中国医学科学院血液学研究所)所院长,北京协和医学院首批长聘教授、博士生导师,干细胞与再生医学系创始主任。兼任所院学术委员会主任、实验血液学国家重点室主任和中国血液病专科联盟理事长。1989年于第二军医大学获医学硕士(血液内科)学位,之后赴美国哈佛医学院等机构深造学习和工作,曾任美国匹兹堡大学终聘教授,2007年7月引进回国。研究方向主要为造血干细胞的生物学特性,血液系统和干细胞相关疾病等。在包括Science、Nature、Cell系列杂志的国内外著名期刊发表论文200余篇,获授权发明专利16项,主编和参编中英文专著10部。现任国际实验血液学会理事和中国生理学会血液学专业委员会主任委员、中国细胞生物学会干细胞生物学分会副会长以及国家卫健委能力建设和继续教育中心“现代医院管理能力建设专家委员会”学科建设与科研管理分委会副主任委员等学会职务,曾任或现任Blood、Leukemia、Experimental Hematology、International Journal of Hematology、Blood Advances、Stem Cells、Stem Cells Translational Medicine等多种国内外杂志编委或副主编。

王栋
教授
王栋,南方医科大学基础医学院教授,博士生导师。2011年毕业于电子科技大学,获生物医学工程博士学位,2006年后先后在哈尔滨医科大学及南方医科大学任职。研究方向为发育与干细胞计算系统生物学,重点关注在造血干细胞发育与分化、RNA数据资源与分析平台等研究领域发展的动向。主持国家自然科学基金面上项目和广东省自然科学基金面上项目等多项课题,以通讯作者发表SCI论文20多篇,研究成果连续发表在Nature Communications、Nucleic Acids Research、Autophagy、Briefings in Bioinformatics和Bioinformatics等学术期刊。
相关论文信息
研究成果发表在Cell Press旗下Cell Stem Cell期刊上,点击“阅读全文”或扫描下方二维码查看论文。
▌论文标题:
Hematopoietic stem cell heterogeneity is linked to the initiation and therapeutic response of myeloproliferative neoplasms
▌论文网址:
https://www.cell.com/cell-stem-cell/fulltext/S1934-5909(21)00018-7
▌DOI:
https://doi.org/10.1016/j.stem.2021.01.018
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




