- +1
游富平团队揭示线粒体蛋白参与调控免疫
原创 Cell Press CellPress细胞科学

生命科学Life science
2021年1月20日,北京大学基础医学院系统生物医学研究所游富平教授团队在Cell Press细胞出版社旗下期刊Cell Reports发表了题为“The mitochondrial protein ERAL1 suppresses RNA virus infection by facilitating RIG-I-like receptor signaling”的研究论文,报道了线粒体蛋白ERAL1参与抗RNA病毒固有免疫调控。该研究拓展了目前对线粒体蛋白参与的固有免疫调控的认识,揭示了利用线粒体蛋白可能是调控固有免疫反应的重要策略。
长按图片识别二维码阅读原文
摘要
线粒体是天然免疫反应的中心。线粒体上的关键分子MAVS是抗病毒RLR通路信号传递的平台,另外,线粒体可以释放损伤相关分子模式(Damage-associated molecular patterns,DAMPs),例如线粒体DNA和RNA,以激活免疫反应。但线粒体蛋白是否被释放出来参与天然免疫反应目前鲜有报道。
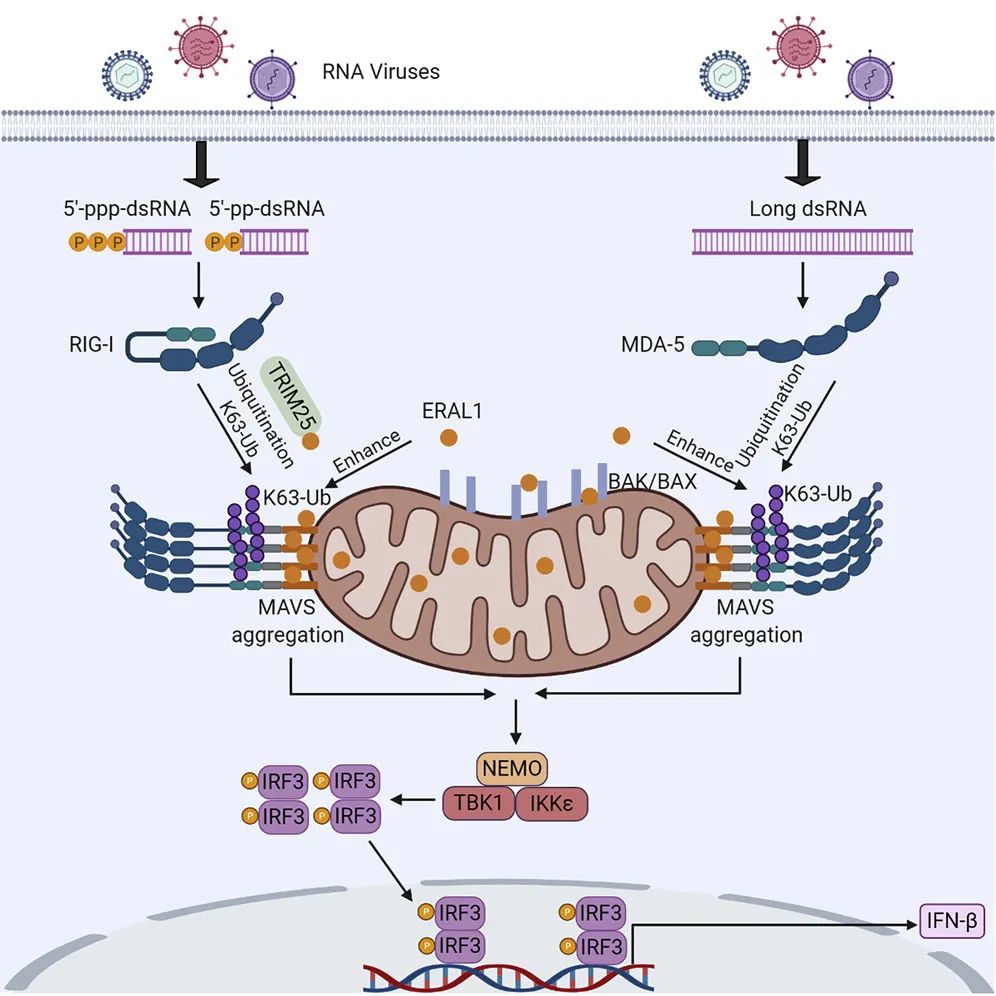
图1.图解摘要
本文中,我们利用邻近标记技术结合质谱的方法,通过对比实验组结果找到并验证了在仙台病毒(SeV)感染后与线粒体外膜蛋白MAVS高亲和力相互作用的蛋白ERAL1。ERAL1缺乏明显抑制了RNA病毒触发的下游抗病毒信号传导,说明ERAL1对于抗RNA病毒固有免疫是非常重要的。
鉴于未感染状态下ERAL1定位于线粒体基质,而MAVS定位于线粒体外膜,我们推测病毒感染后ERAL1可能会发生位置的改变。接下来,通过多种实验方法,我们发现病毒感染后细胞质中可以检测到ERAL1。应激状态下,线粒体外膜会发生通透性改变(Mitochondrial outer membrane permeablisation,MOMP),同时线粒体会向胞质释放多种蛋白,介导下游反应。其中,Bcl-2家族蛋白BAX/BAK在MOMP的发生过程中发挥关键作用,并且ERAL1从线粒体释放到细胞质依赖于BAX/BAK蛋白。
接下来,我们使用邻近标记技术,寻找ERAL1参与抗RNA病毒固有免疫调控的机制。我们发现,病毒感染后ERAL1除了可以与MAVS相互作用外还可以与TRIM25相互作用。TRIM25作为E3泛素连接酶可以使RIG-I CARD结构域发生K63位泛素化,并稳定MAVS的聚合。我们发现ERAL1可以通过依赖TRIM25的方式正向调控抗病毒RLR信号通路。
本文的研究显示,病毒感染条件下,线粒体可通过释放蛋白介导固有免疫反应,提示线粒体在固有免疫调控中的重要作用。
作者专访
Cell Press细胞出版社微信公众号特别邀请游富平教授及其团队进行了专访,请他们进一步为大家详细解读。
CellPress:
首先,请您和您的团队介绍一下为什么会选择线粒体基质蛋白作为研究对象?
游富平教授及其团队:
近年来,越来越多的研究证据表明线粒体不仅是“能量工厂”,并且在免疫反应中也发挥了重要作用,线粒体在天然免疫反应中扮演着越来越重要的角色。线粒体上的关键分子MAVS可以作为信号传递的平台参与抗RNA病毒RLR信号通路。真核细胞线粒体起源于古生菌,因而我们推测线粒体在抗病毒免疫中的作用绝不仅仅局限于MAVS,线粒体中的其他蛋白也有参与固有免疫的可能。基于上述猜测,我们使用邻近标记技术结合质谱的方法,鉴定出仙台病毒(SeV)感染后可以与线粒体外膜蛋白MAVS高亲和力相互作用的蛋白ERAL1。ERAL1是线粒体基质蛋白,因而我们的研究重点就是解释线粒体基质蛋白ERAL1如何参与固有免疫调控的。
CellPress:
线粒体蛋白ERAL1是如何参与RNA病毒触发的先天免疫的?
游富平教授及其团队:
应激状态下,线粒体外膜会发生通透化,同时线粒体蛋白会向胞质中释放,介导下游反应。Bcl-2家族蛋白BAX/BAK在通透化的过程中发挥关键作用。ERAL1从线粒体释放到细胞质依赖于BAX/BAK蛋白。为了进一步探讨ERAL1参与抗病毒免疫反应的机制,我们使用邻近标记技术,寻找可能介导ERAL1信号的相关分子。质谱结果显示,病毒感染后ERAL1除了可以与MAVS相互作用外还可以与TRIM25相互作用。TRIM25是最早被发现的参与RIG-I K63位泛素化激活的E3泛素连接酶。我们的研究结果显示SeV感染后,ERAL1依赖TRIM25增强RIG-I K63泛素化水平,进而增强MAVS的多聚,促进抗病毒固有免疫。
CellPress:
ERAL1对于体内抗RNA病毒反应有怎么样的意义?
游富平教授及其团队:
ERAL1在抗RNA病毒的角色有些类似于DAMP。病毒感染的情况下线粒体发生了损伤,其通透性发生了变化。ERAL1被释放到细胞胞浆中,发挥了放大器的功能,进一步增强和维持抗病毒免疫的状态,使得机体能够有效清除病毒。
CellPress:
ERAL1是如何促进MAVS聚合的?
游富平教授及其团队:
已知RNA病毒受体RIG-I/MDA5的K63位泛素化能够促进MAVS多聚体的稳定性,我们发现ERAL1可以从线粒体转运到细胞质并促进RIG-I/MDA5的K63位泛素化。活化后RIG-I/MDA5进一步稳定MAVS的聚合。而ERAL1和MAVS的直接相互作用,是否参与了MAVS多聚化的发生,我们正在研究当中。
CellPress:
在研究过程中,您认为最难攻克的点在哪里?
游富平教授及其团队:
为了解释线粒体基质蛋白ERAL1参与RLR信号通路的机制,我们猜测病毒感染后ERAL1会发生位置的改变。我们采用多种方法,进行了大量实验以证实上述猜测,但是在这个过程中我们发现细胞状态会影响实验结果。另外,线粒体是细胞中极其重要的细胞器,ERAL1是线粒体核糖体重要的组成因子,ERAL1敲除会导致细胞凋亡,胚胎致死,因而我们无法得到纯合敲除的实验对象,只能使用杂合细胞和小鼠进行实验。
CellPress:
接下来,您和您的团队新的研究方向是什么?
游富平教授及其团队:
有以下几个方向:线粒体蛋白质释放的过程是否有其他分子的参与?病毒感染后释放的ERAL1是否具有其他的功能?是否有其他的线粒体蛋白在病毒感染后释放到细胞质,这些释放的蛋白具体发挥何种作用?

相关论文信息
研究成果发表在Cell Press旗下Cell Reports期刊上,点击“阅读全文”或扫描下方二维码查看论文。
▌论文标题:
The mitochondrial protein ERAL1 suppresses RNA virus infection by facilitating RIG-I-like receptor signaling
▌论文网址:
https://linkinghub.elsevier.com/retrieve/pii/S221112472031620X
▌DOI:
https://doi.org/10.1016/j.celrep.2020.108631
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




