- +1
总结过去的一年里,CRISPR在临床中的突破性进展
原创 生物世界 生物世界 收录于话题#CRISPR71个
编译|王聪
来源|Nature
排版|水成文
在过去的2020年里,CRISPR风头一时无两,Emmanuelle Charpentier 和 Jennifer Doudna 因CRISPR基因编辑荣获诺贝尔化学奖。此外,在这一年里,CRISPR基因编辑取得了长足进步,从开发更有效的基因编辑工具,到治疗癌症和遗传疾病,CRISPR开始从一个基础研究工具成功迈入临床应用。
临床试验
CRISPR Therapeutics(由Emmanuelle Charpentier等人创立 )和Beam Therapeutics(由刘如谦等人创立)等CRISPR领域初创公司都将注意力放到了了血红蛋白病上,例如β-地中海贫血和镰状细胞病。这两种疾病都是由编码血红蛋白的基因的单碱基突变引起的,并可能导致危及生命的疾病。

不过,这些公司并未使用CRISPR技术修复或替换这些突变基因,而是采用了“曲线救国”的方式,BCL11A是一种转录因子,可抑制红系细胞中的γ-珠蛋白和胎儿血红蛋白表达,通过CRISPR技术抑制BCL11A,就能重新激活γ-珠蛋白表达,从而治疗地中海贫血症和镰刀状细胞贫血症。
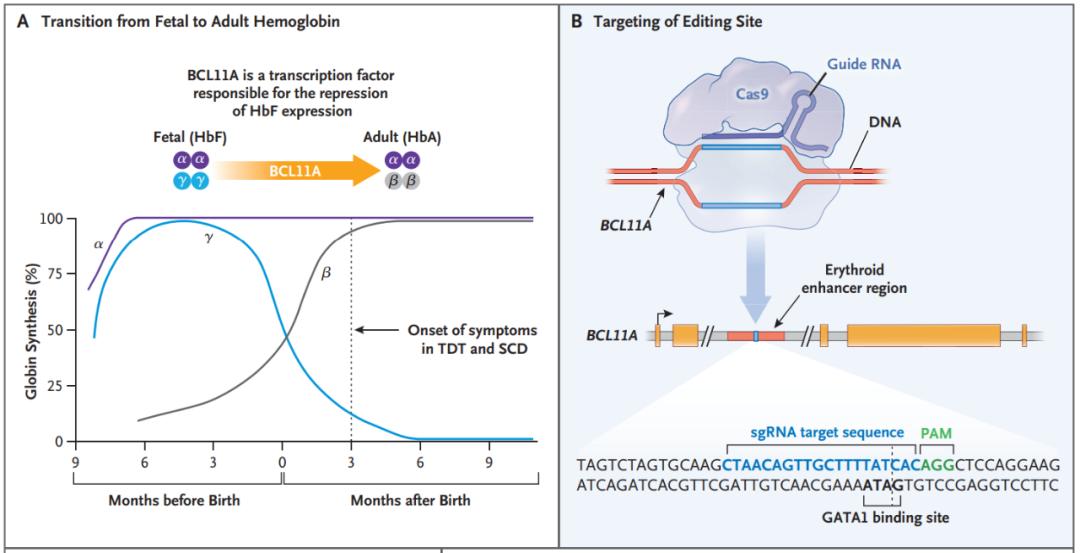
2020年11月,CRISPR Therapeutics宣布了其名为CTX001的疗法取得了早期成功,该疗法通过电穿孔将CRISPR-Cas9递送至造血干细胞。用白消安对患者自身的造血干细胞进行化学清除后,将被CRISPR-Cas9编辑后的造血干细胞输注回患者体内。四名接受治疗的β-地中海贫血或镰状细胞病患者不再依靠输血治疗。
该临床试验结果于2020年12月5日在《新英格兰医学期刊》发表,详情:这项临床试验的成功,是CRISPR基因编辑的一个巨大胜利,2012年,Emmanuelle Charpentier 和 Jennifer Doudna 搞清楚了CRISPR-Cas9生化原理,而在2020年,已经用于治疗人类遗传病,这标志着使用CRISPR治疗疾病不再是一个理论上的想法,而几乎是一个肯定的治疗方法。
最近,Editas Medicine(由张锋等人创立)正在进行另一项CRISPR临床试验,通过将CRISPR基因编辑系统直接递送到眼睛,以删除引起遗传性失明的基因突变,治疗先天性黑蒙症10型。详情:

单碱基编辑
单碱基编辑(Base Editing),是一种基于CRISPR的变体,由哈佛大学化学家刘如谦(David Liu)等人开发。

2016年4月20日,刘如谦等人在 Nature 发表论文,首次可以通过可靠、可预测的方法,实现对改变活细胞基因组中的单个碱基进行修改。
2017年10月25日,刘如谦等人进一步升级,开发出了单碱基编辑器(Base Editor),将Cas9和APOBEC(胞嘧啶脱氨酶)整合,能够在不造成DNA双链断裂的情况下,将A-T碱基对转换为G-C碱基对,实现对基因组点突变的定点矫正修复。
紧接着,刘如谦等人创立了Beam Therapeutics,致力于将单碱基编辑技术带向临床应用。
2020年7月8日,刘如谦团队在 Nature 杂志发表研究论文,发现并命名了一种细菌毒素——DddA,它可以催化双链DNA(dsDNA)中胞苷的脱氨,将胞嘧啶(C)转化为尿嘧啶(U)。将DddA分裂半体与转录激活子样效应子阵列蛋白(TALE)和尿嘧啶糖基化酶抑制剂融合,产生无RNA的DddA衍生的胞嘧啶碱基编辑器(DdCBE),可催化人线粒体DNA(mtDNA)中C•G到T•A的转化,且具有很高的靶向特异性和编辑准确性。这一不依赖CRISPR的碱基编辑器——DdCBE,能够实现对线粒体基因组(mtDNA)的精准编辑,这为研究线粒体遗传病和治疗线粒体遗传病带来了前所未有的工具。详情:2020年6月3日,刘如谦等在 Science Translational Medicine 杂志发表封面论文,通过双AAV载体递送单碱基编辑器,成功恢复Tmc1基因隐性突变导致的完全耳聋小鼠的听力。这是人类首次通过基因编辑技术解决隐性遗传突变导致的遗传疾病。详情:2020年6月1日,Nature Biotechnology杂志同期发表了来自华东师范大学李大力等团队的四篇研究论文,这些研究表明,单碱基编辑器可以实现同时编辑多个位点,这意味着,单碱基编辑系统有很大的潜力改造工程T细胞,用于癌症治疗。
癌症免疫疗法
2020年2月28日,宾夕法尼亚大学癌症生物学家 Carl June 在 Science 杂志上发表封面论文,这是第一个多重CRISPR/Cas9编辑工程改造的T细胞进行癌症治疗的人类临床试验,实验结果表明了该疗法在难治性癌症患者中的安全性和可行性。详情:

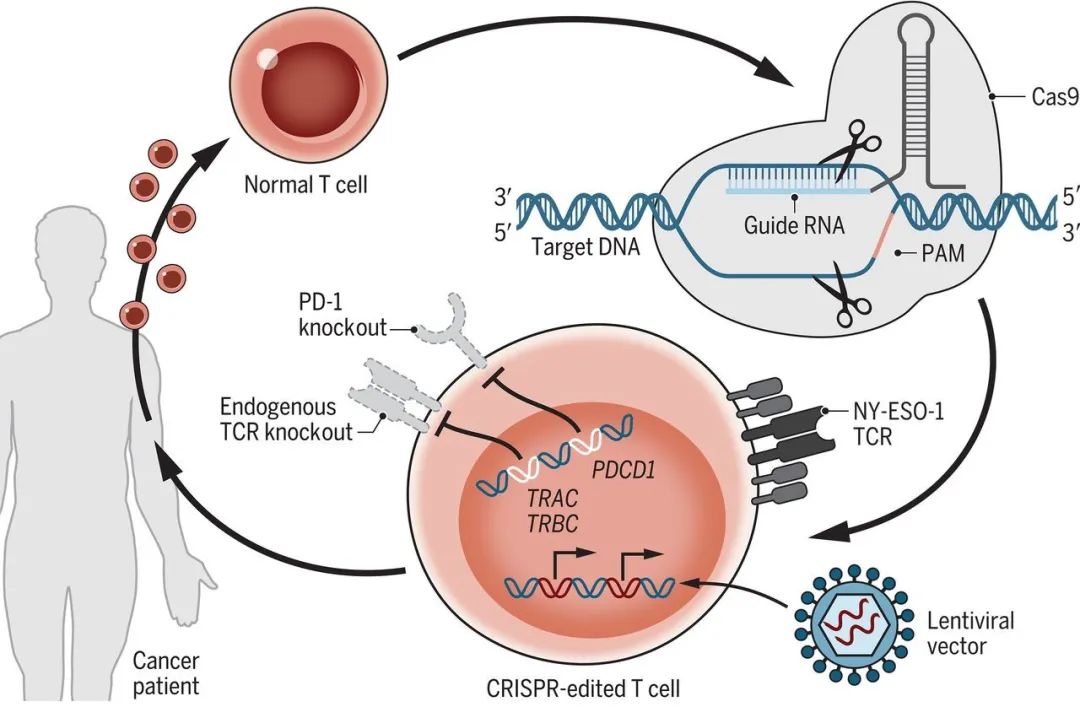
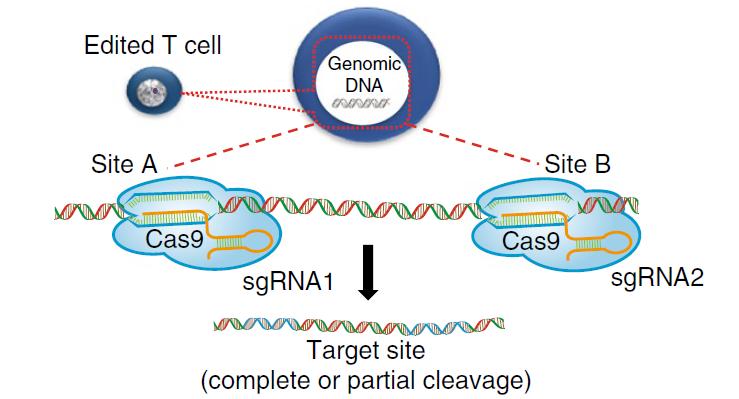
2020年4月28日,华西医院卢铀教授团队在 Nature Medicine 发表论文,该论文报道了使用CRISPR-Cas9技术编辑非小细胞肺癌患者T细胞PD-1基因的首个人类I期临床试验结果(ClinicalTrials.gov NCT02793856)。结果表明:CRISPR-Cas9基因编辑的T细胞的临床应用通常是安全可行的,未来的试验应使用改进的基因编辑方法来提高治疗效果。详情:

而明尼苏达大学的Branden Moriarity则致力于使用CRISPR技术来改造自然杀伤细胞(NK细胞),从而创造出与CAR-T细胞疗法等效的疗法,以选择性地根除癌细胞。
CRISPR的递送问题
目前来说,腺相关病毒(AAV)是用于体内基因治疗的最佳递送载体,但是AAV病毒尺寸太小,以至于只能包装进少量DNA,而Cas9通常比较大,这也是CRISPR-Cas9基因编辑应用受限的一大因素。
为了解决这一难题,科学家们从两方面开始努力,一是开发替代性递送载体,例如脂质纳米颗粒(LNP),一是寻找更小尺寸的Cas9蛋白。

2020年11月,Intellia Therapeutics(由Jennifer Doudna等创立)通过脂质纳米颗粒(LNP)递送CRISPR-Cas9,用于治疗遗传性转甲状腺素蛋白淀粉样变性(hATTR)患者。
Beam Therapeutics公司也已开始研究使用基于阳离子脂质纳米颗粒来递送CRISPR系统用于治疗遗传学肝病。
此外,还有一些病毒学家则致力于改进AAV病毒,使其能够容纳更多DNA。
在新冠肺炎中大显身手
新冠肺炎大流行成为了改变了全球性的事件,但它也为CRISPR提供了闪耀的机会。

新冠疫情爆发后,两家生物技术诊断公司Sherlock Biosciences(由张锋等人创立)和Mammoth Biosciences(由Jennifer Doudna等人创立)各自迅速行动,开发基于CRISPR的新冠病毒诊断试剂盒。详情:2020年5月,Sherlock Biosciences的新冠诊断试剂盒获得了美国食品药物监督管理局(FDA)的紧急使用授权。
用于治疗艾滋病
实际上,CRISPR既然能用于检测病毒,那么也能用于对抗和清除病毒。
2020年11月27日,美国天普大学的研究人员在 Nature Communications 杂志上发表论文。
这项研究使用Excision BioTherapeutics开发的CRISPR基因编辑技术,成功地在非人灵长类动物的基因组中编辑清除了与HIV密切相关的SIV-a病毒,这在艾滋病研究中迈出了重要一步。这一突破也使得人类比以往任何时候都更接近于开发出彻底治愈艾滋病的方法。详情:

尽管抗逆转录病毒药物可以将HIV含量降低到接近零,但HIV病毒可以通过将其基因组插入人体DNA中而潜伏下来。Excision BioTherapeutics对CRISPR-Cas9进行编程,使其靶向宿主细胞中的HIV基因序列并将其切碎,从而消除了HIV病毒库并治愈感染。
参考资料:
https://www.nature.com/articles/s41591-020-01222-4
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




