- +1
【学术前沿】高嵩/胡俊杰合作揭示“里迎外合”的线粒体融合机制
以下文章来源于CellPress细胞科学 ,作者Cell Press

CellPress细胞科学
1974年,我们出版了首本旗舰期刊《细胞》。如今,CellPress已发展为拥有50本期刊的全科学领域国际前沿学术出版社。我们坚信,科学的力量将永远造福人类。

关注我们,获取更多相关资讯
线粒体作为细胞的能量工厂,负责将机体摄入的营养源源不断地转换为细胞内的能量“通货”,同时自身也处于不断分裂与融合的高度动态之中,而这种动力学平衡一旦被破坏,则会导致多种疾病的发生。
近日,中山大学肿瘤防治中心高嵩研究员与中科院生物物理所胡俊杰研究员共同在Cell Press细胞科学旗下期刊Trends in Cell Biology发表了名为“Mitochondrial Fusion: The Machineries In and Out”的综述文章,系统地回顾了近20年来关于线粒体融合蛋白的结构研究,探讨了这些关键分子在介导线粒体融合中的作用,以及由线粒体融合异常所致的神经系统疾病的分子机理。
▲长按识别二维码阅读论文
线粒体融合结构单元
线粒体是高度动态的细胞器,在细胞中不断发生着分裂和融合。哺乳动物中的线粒体融合素1/2 (mitofusin, MFN 1/2)与视神经萎缩蛋白1 (optic atrophy 1, OPA1),或酵母中的Fzo1与Mgm1,分别介导线粒体外膜(OMM)及线粒体内膜(IMM)的融合。人类中的MFN2或OPA1突变分别会引起神经肌肉疾病2A型腓骨肌萎缩症(CMT2A)和常染色体显性视神经萎缩症(ADOA)。
线粒体融合的具体机制尚不清楚,部分原因是由于缺乏这些融合蛋白的结构信息,而最近报道的MFN和OPA1的几种晶体结构及冷冻电镜结构解析使得对于相关机制的深入挖掘成为可能。
线粒体融合原与发动蛋白超家族的结构联系
在真核细胞中,参与各种膜重塑事件的MFN和OPA1属于多结构域GTPases的发动蛋白(Dynamin)超家族。发动蛋白及各类发动蛋白样蛋白(DLP)的功能包括在胞吞过程中从质膜上裂解被网格蛋白包裹的囊泡、介导线粒体的分裂及催化内质网融合等。
DLP都包含一个GTPase(G)结构域和一个螺旋区。前人的生化和结构研究揭示了DLP的许多重要共同特征,例如:①与经典的小GTPase(如Ras和Rab)相比,DLP具有一个更大的G结构域,其结合鸟嘌呤核苷酸的亲和力较弱;②在GTP水解循环中,DLP通常不需要特定的GTP酶激活蛋白(GAP)或鸟嘌呤核苷酸交换因子(GEF),其GTPase活性是由G结构域的同源二聚化体激发,并且似乎能够自发的重新装载GTP;③DLP的功能依赖于由GTP水解所调节的结构域之间的相对运动。而MFN和OPA1作为最后解析的发动蛋白家族成员,其结构与其他已知结构的DLP有联系,亦有区别。
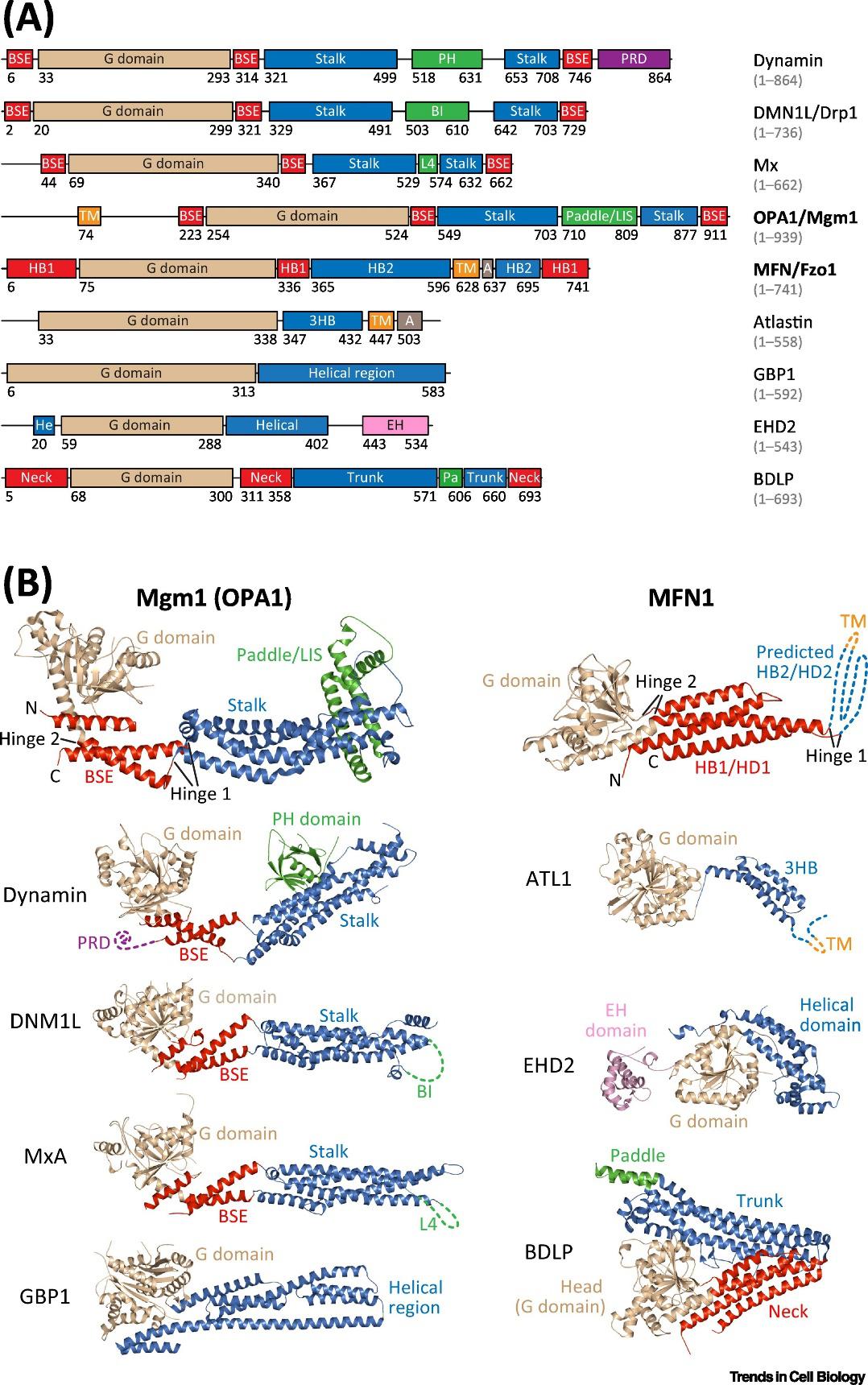
▲图1. 多种发动蛋白样蛋白(DLP)的结构比较
MFN结构与线粒体外膜融合
MFN介导的OMM融合可以归为拴连(tethering)、贴靠(docking)和合并(merger)三步。在较早的研究中,MFN被描述为通过两个跨膜螺旋锚定到线粒体外膜(OMM)的V形分子,其组成包括G结构域和两个七肽重复序列,在此基础上提出了类似于SNARE复合物的OMM融合的SNARE样OMM拴连(tethering)模型,而最近的研究显示GTP结合-水解循环在线粒体外膜融合过程中起着关键作用,由此诞生了G结构域介导的拴连模型。在目前的拴连模型中,MFN介导的OMM融合可以归为拴连、贴靠(docking)和合并(merger)三步。MFN之间的反式相互作用也至关重要。在GTP水解过程中,来源于不同线粒体的MFN通过G结构域形成反式二聚体,并且使其他结构域发生进一步位移相对运动,最终导致相互两个距离较近邻近的线粒体外膜融合。
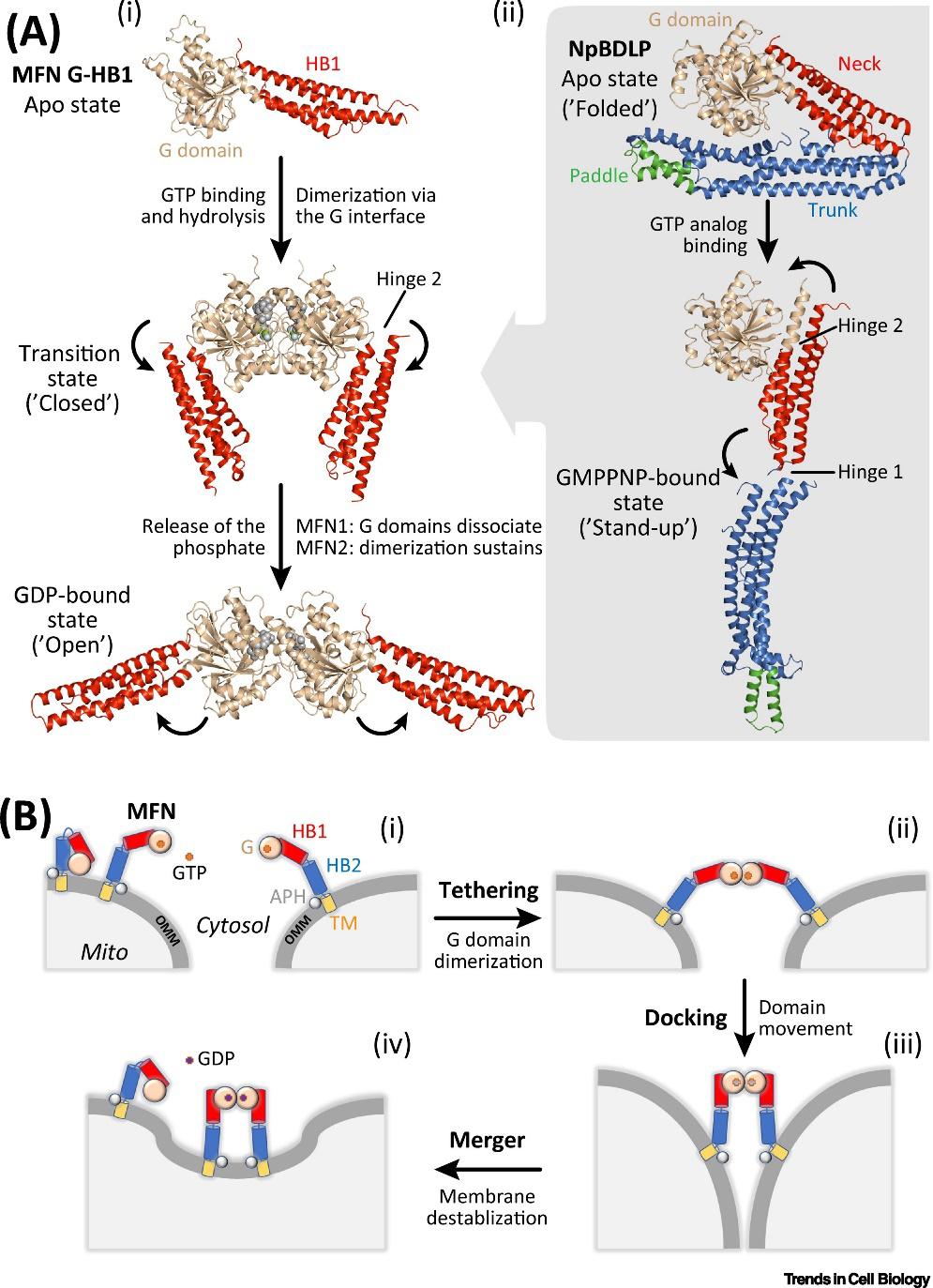
▲图2.MFN的结构与融合模型
MFN1和MFN2在线粒体外膜融合过程中也具有不同作用。MFN2具有比MFN1更紧密的G结构域结合介面,而灵长类动物中MFN1的GTPase酶活性则远高于MFN2。,此外,也有研究显示MFN1和MFN2可以通过G结构域形成异源二聚体,并且MFN1-MFN2反式异二聚体具有更高的融合效率。然而,由于MFN的全长结构目前仍然未知,线粒体外膜最终融合的具体机制仍并不十分明确。
OPA1结构与线粒体内膜融合
线粒体内膜(IMM)融合的机制可能比OMM的更为复杂。一旦两个线粒体的外膜融合在一起,它们的内膜会迅速合并以完成整个线粒体的融合。另外,IMM融合蛋白Mgm1和OPA1在融合之前必须经过蛋白酶剪切,以产生活性片段。有研究显示OPA1缺失不仅会引起线粒体片段化,而且其中的嵴也减少了,导致IMM变成囊泡,由此揭示OPA1还参与线粒体嵴的形成。
与具有统一朝向的OMM融合蛋白不同的是,IMM融合蛋白的各个结构域之间能够通过多种分子间相互作用形成不同朝向的结合界面,如 “头对头”、“头对尾”、“背靠背”等,其中“背靠背”式与“头对头”式的Mgm1/OPA1被发现可能对于嵴的形成具有重要作用,而“头对尾”式则更有可能在引发IMM融合中扮演关键角色。
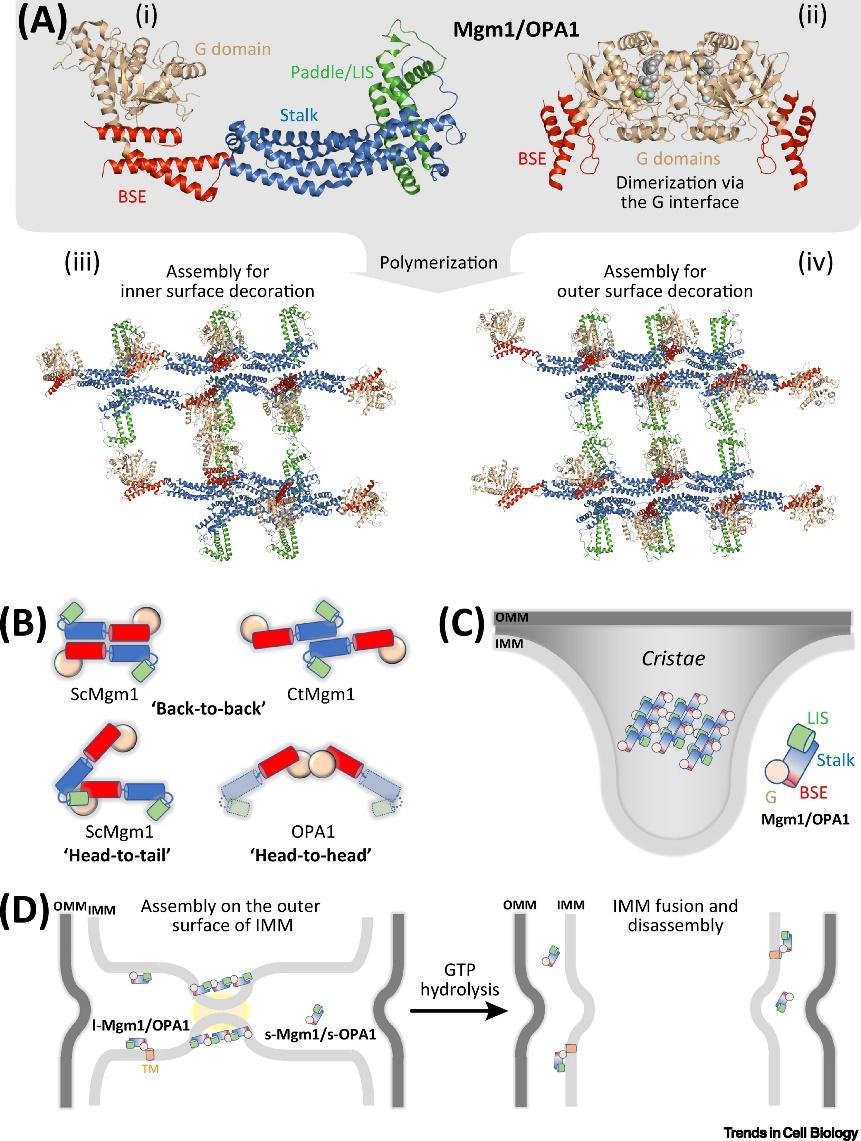
▲图3. Mgm1/OPA1的结构与融合模型
线粒体融合研究的启示
MFN2突变能够直接影响线粒体外膜的拴连与融合,而OPA1突变则更多地影响了嵴形成或膜稳定,从而间接破坏内膜融合。另外与2A型腓骨肌萎缩症相关的多种MFN2突变体能够有效地与正常MFN1或MFN2结合,由此导致了显性负效应。
膜的融合与分裂是两种完全相反的反应,但线粒体内膜融合蛋白也显示出膜分裂相关蛋白的部分特征。另外,由于一些关键的结构还仍未被解析,借助cryo-ET和FRET等生物物理技术将也有助于我们获取有关线粒体融合蛋白的更多信息,以回答 “线粒体融合的完整过程是什么样的”、“内外膜融合如何协调”等关键问题。
本文参考文献(上线划动查看)
1. Gao, S. & Hu, J. Mitochondrial Fusion: The Machineries In and Out. Trends in Cell Biology 31, 62-74, doi:10.1016/j.tcb.2020.09.008 (2021).
2. Koshiba, T. et al. Structural Basis of Mitochondrial Tethering by Mitofusin Complexes. Science 305, 858, doi:10.1126/science.1099793 (2004).
3. Alexander, C. et al. OPA1, encoding a dynamin-related GTPase, is mutated in autosomal dominant optic atrophy linked to chromosome 3q28. Nat Genet 26, 211-215, doi:10.1038/79944 (2000).
4. Faelber, K. et al. Crystal structure of nucleotide-free dynamin. Nature 477, 556-560, doi:10.1038/nature10369 (2011).
5. Ford, M. G., Jenni, S. & Nunnari, J. The crystal structure of dynamin. Nature 477, 561-566, doi:10.1038/nature10441 (2011).
作者专访
Cell Press细胞出版社特别邀请高嵩研究员与胡俊杰研究员进行了专访,请他们为大家进一步详细解读。
CellPress:
请问两位老师是如何选择线粒体融合这个研究方向的?
高嵩研究员与胡俊杰研究员:
线粒体融合具有重要的生理和病理意义。介导线粒体内外膜融合的分子均属于发动蛋白超家族,且是这个GTP酶家族中被发现较早但分子机制知道最少的几个蛋白。胡俊杰课题组主要聚焦内质网的结构与功能,前期研究中发现了与MFN很类似的内质网融合素ATL,高嵩课题组此前则专注于发动蛋白家族成员的结构和作用机制研究,由此,两个课题组不约而同的把目光聚焦到线粒体融合机制这个研究方向。
CellPress:
目前在线粒体融合蛋白研究领域的最新进展如何?能否请您简述一下此篇综述研究的几个重要发现?
高嵩研究员与胡俊杰研究员:
目前,外膜融合蛋白MFN1和MFN2的G-HB1部分已分别有了几个不同构象的结构,暗示MFN的工作模式与ATL介导的内质网融合比较相似。内膜融合蛋白Mgm1/OPA1有多个晶体和电镜的结构报道,揭示几个关键的分子间装配的界面。MFN2和OPA1的G-HB1结构覆盖了两个分子绝大部分疾病突变的位点,为相关病理机制的解读提供了重要依据。
CellPress:
根据目前研究进展,线粒体融合异常可能引起哪些疾病?可能的分子机理是什么?
高嵩研究员与胡俊杰研究员:
目前已知的融合相关疾病,包括MFN2突变导致的腓骨肌萎缩症(CMT2A)和OPA1突变导致的常染色体显性视神经萎缩症(ADOA)。线粒体融合动态对所有细胞均有重要作用,但这些突变导致的症状更多与神经退行性疾病相关,可能是由于这些蛋白的组织表达特异性以及神经细胞对能量的高度依赖导致的。上面提到,这些突变主要出现在MFN2和OPA1的G-HB1结构域中,说明GTP酶的二聚化等功能以及GTP水解带动的HB1的摆动在这些分子发挥作用是至关重要。当然,其他很多突变可能是影响了分子整体的折叠和稳定性,使得这些蛋白质机器直接丧失了功能。
CellPress:
基于对线粒体融合的研究成果,您认为后续研究应该往哪些方向进行?
高嵩研究员与胡俊杰研究员:
后续的线粒体融合研究应聚焦于MFN和OPA1的全长高分辨率结构解析,以及利用生物物理手段阐释这些全长分子的关键构象变化和装配方式。此外,外膜和内膜的融合反应是如何高度偶联的也有待于深入研究。基于单个的内质网融合素ATL可在体外重塑类似内质网管状网络的事实,我们推测MFN和OPA1的联合重组有可能在试管里重现类似于线粒体的双层膜结构,这将为线粒体结构与功能的研究提供一个重要的平台。线粒体融合对细胞功能和命运具有重要的影响,并与多种人类疾病的发生发展相关。因此,未来也有必要针对线粒体融合蛋白的结构和作用机制开发干预线粒体融合的手段,从而为相关疾病的诊治提供新途径。
相关文章信息
研究成果发表于在Cell Press旗下Trends in Cell Biology期刊上,点击“阅读原文”或扫描下方二维码查看论文
▌论文标题:
Mitochondrial Fusion: The Machineries In and Out
▌论文网址:
https://www.cell.com/patterns/fulltext/S2666-3899(20)30068-4
▌DOI:
https://doi.org/10.1016/j.tcb.2020.09.008
来源:CellPress细胞科学
—END—
原标题:《【学术前沿】高嵩/胡俊杰合作揭示“里迎外合”的线粒体融合机制》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




