- +1
【学术前沿】Protein & Cell | 韩家淮/帅建伟合作揭示细胞坏死小体介导细胞命运抉择的…

细胞死亡是细胞在漫长的进化过程中获得的一种自杀机制,在清除机体内无用、多余及病变的细胞,维持正常发育、组织形态和机体内环境稳定等方面都起到关键性作用。细胞坏死是细胞死亡的主要方式之一,在病毒感染、炎症反应等过程中具有重要生理学意义,同时在急性胰腺炎、神经退化、缺血性伤害、动脉粥样硬化等疾病中也扮演了重要的角色。肿瘤坏死因子(TNF)是迄今为止所发现的能够特异性杀死癌细胞并抑制其增殖功能的最强生物活性因子,但由于其还会引起组织坏死,产生严重的毒副作用并对周围组织造成破坏,从而极大地限制了其在临床上的应用【1】。
在TNF介导的信号通路中,RIP1和RIP3相互结合形成的坏死小体复合体是坏死信号传递的必要过程【2】。大量体内和体外研究表明RIP1是细胞坏死发生的关键蛋白,然而,近年来越来越多的证据表明RIP1在一定条件下会抑制坏死过程的发生。RIP1基因敲除的小鼠在出生时死于系统性炎症,RIP3和caspase-8双基因敲除可以挽救小鼠的围产期死亡【3】。对caspase-8的招募是RIP1阻滞细胞坏死发生的关键过程,caspase-8可以通过剪切RIP1/RIP3复合物,从而破坏其稳定性【4】。这些报道表明RIP1对细胞坏死同时具有促进和抑制两种调控方式,但对于如何实现这种复杂的双重调控机制,以及其内在的动力学行为如何抉择细胞命运,是细胞死亡研究领域亟待解决的关键科学问题。
近日,厦门大学生命科学学院韩家淮课题组和物理科学与技术学院帅建伟课题组合作在 Protein & Cell 杂志上发表题为RIP1-dependent linear and nonlinear recruitments of caspase-8 and RIP3 respectively to necrosome specify distinct cell death outcomes 的研究文章,报道了RIP1如何定量调控细胞坏死小体复合物的招募,进而导致细胞不同命运的抉择机制。

研究团队首先基于自主开发的Group-DIA非靶向质谱数据分析方法【5】,定量获取TNF信号通路中TNFR1复合物、RIP1复合物及RIP3复合物在L929纤维肉瘤细胞中的绝对分子数量。结合该定量数据,首次构建了TNF介导细胞坏死的信号网络模型。通过模型预测和实验验证表明RIP1对RIP3的磷酸化具有双向调节功能,即低浓度的RIP1促进RIP3磷酸化,而高浓度的RIP1则抑制RIP3磷酸化的发生。RIP1在细胞中的表达水平直接决定其是促进还是抑制细胞坏死过程的发生。
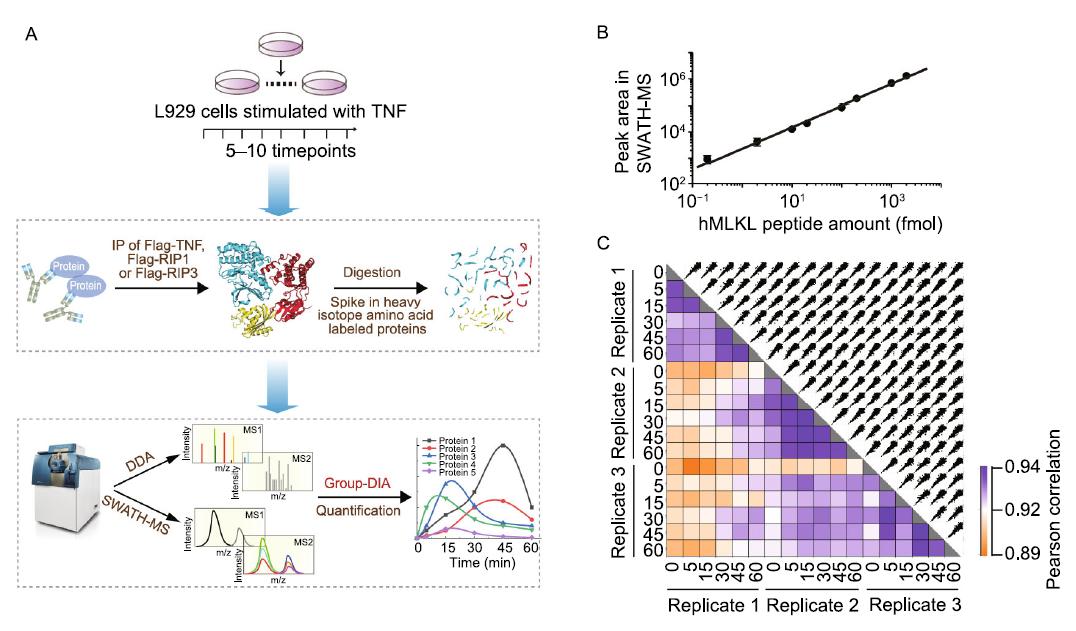
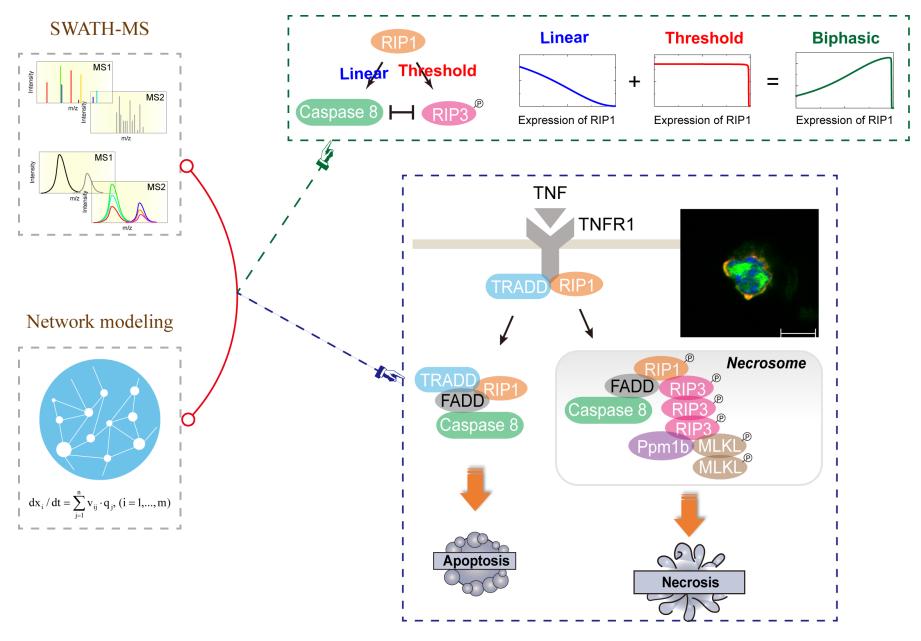
进一步的理论预测及实验证实,caspase-8表达量的降低直接减小了高浓度RIP1对RIP3磷酸化抑制的影响,表明RIP1对caspase-8的招募是其双向调节细胞坏死的直接原因。而决定RIP1双向调节的关键机制在于RIP1对caspase-8及RIP3的不同招募动力学行为。研究发现caspase-8的招募是线性依赖RIP1的表达水平,而RIP3磷酸化则呈现出对RIP1表达水平的极低阈值响应行为,即2%的RIP1正常表达水平就足以使得RIP3磷酸化达到峰值。
研究组进一步结合实验分析及模型优化,发现了高浓度RIP1除了抑制RIP3磷酸化介导的细胞坏死,同时也会阻滞TRADD介导的细胞凋亡。模型的拓扑结构分析和实验结果表明,TRADD并不存在于含有RIP3的坏死小体复合物中,RIP1表达水平的降低可以同时触发细胞坏死和细胞凋亡。该结果揭示细胞坏死和细胞凋亡之间并不是绝对的相互抑制关系,在一定条件下它们可以同时发生。除了在细胞群体行为中,研究组还在单个细胞中观测到了坏死信号和凋亡信号被同时激活的现象,表明在单个细胞中两种死亡方式也可共存发生。
最后,研究组在L929纤维肉瘤细胞中定量描绘出RIP1精准抉择细胞命运的场景:当RIP1在细胞中的表达水平低于每细胞约1,000个分子(mpc)时,该细胞仅发生TRADD依赖性细胞凋亡;当其水平高于1,000 mpc时,caspase-8和RIP3分别被募集到坏死小体,对RIP1表达量分别呈现出线性和非线性依赖关系的动力学响应行为,并触发细胞坏死和凋亡的同时发生;过高的RIP1表达(>46,000 mpc)则抑制细胞凋亡,仅导致细胞坏死。
综上所述,该研究定量阐述了细胞坏死小体中各组分相互作用的程度和动力学模式对细胞命运抉择有至关重要的影响,为后续精准定量研究细胞生存和死亡动力学行为及调控机制提供了方向。
韩家淮课题组博士后李翔、副教授钟传奇以及研究生吴睿是该论文的第一作者,韩家淮院士和帅建伟教授为该论文的共同通讯作者。
文章链接:
https://link.springer.com/article/10.1007/s13238-020-00810-x

参考文献
1. Han J, Zhong CQ, Zhang DW (2011) Programmed necrosis: backup to and competitor with apoptosis in the immune system. Nat. Immunol. 12:1143–1149.
2. Zhang DW, Shao J, Lin J, Zhang N, Lu BJ, Lin SC, Dong MQ, Han J (2009) RIP3, an energy metabolism regulator that switches TNF-induced cell death from apoptosis to necrosis. Science 325:332–336.
3. Dillon CP, Weinlich R, Rodriguez DA, Cripps JG, Quarato G, Gurung P, Verbist KC, Brewer TL, Llambi F, Gong YN et al (2014) RIPK1 blocks early postnatal lethality mediated by caspase-8 and RIPK3. Cell 157:1189–1202.
4. Newton K, Wickliffe KE, Dugger DL, Maltzman A, Roose-Girma M, Dohse M, Kőműves L, Webster JD, Dixit VM (2019) Cleavage of RIPK1 by caspase-8 is crucial for limiting apoptosis and necroptosis. Nature 574:428–431.
5. Li Y, Zhong CQ, Xu X, Cai S, Wu X, Zhang Y, Chen J, Shi J, Lin S, Han J (2015) Group-DIA: analyzing multiple data-independent acquisition mass spectrometry data files. Nat Methods 12:1105–1106.
(可上下滑动浏览)
来源:BioArt
原标题:《【学术前沿】Protein & Cell | 韩家淮/帅建伟合作揭示细胞坏死小体介导细胞命运抉择的定量调控机制》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




