- +1
新冠待解|突变是病毒的“天性”,这会成为疫苗“克星”吗?
人类和新冠病毒(SARS-CoV-2)较量一年之后,全球重启的“杀手锏”——疫苗终于来了。但与此同时,英国率先报的新冠病毒变异毒株B.1.1.7谱系(英国将其命名为“VOC 202012/01”)开始席卷欧洲,并向全球蔓延。这多少冲淡了疫苗带来的喜悦。人们不禁担忧:难道病毒再度快我们一步?
“从现在的情况来看,B.1.1.7对我们在研的的抗体药物和疫苗不会产生负面影响,所以我们暂时可以松一口气。”清华大学医学院和万科公共卫生与健康学院张林琦教授在接受澎湃新闻(www.thepaper.cn)记者采访时如是表示。
上海复旦大学附属华山医院感染科主任张文宏也表示“在疫苗出来之前就发生对疫苗无效的变异可能性不大。”
张文宏解释称,没有自然选择就没有病毒进化。同样,没有疫苗的压力,也基本不能自然筛选出对疫苗无效的病毒变异株。目前疫苗会产生针对S蛋白许多区域的抗体,一个单一的突变(比如之前出现的D614G突变,和这次出现的N501Y突变)降低疫苗的效力可能性不大。
这也是目前科学界的主流观点。当地时间2020年12月31日晚,世卫组织(WHO)正式通报了新冠病毒自出现以来的主要变异情况,包括四种变体。其中提到,2020年12月14日,英国向世卫组织报告了一种被命名为VOC 202012/01的新冠病毒变体,最初出现在英格兰东南部。初步的流行病学研究表明,该变体具有更强的传播力,但其导致的疾病严重程度(以住院时间和28天死亡率评估)及再感染情况并没有变化,大多数诊断工具不受影响。
不过,道高一尺,魔高一丈,随着疫苗的大面积接种,新冠病毒可能会在中和抗体的压力之下突变,从而逃脱免疫。复旦大学病原微生物研究所所长姜世勃接受澎湃新闻(www.thepaper.cn)采访时表示,“新冠病毒作为一种RNA病毒,较易发生变异,大规模接种COVID-19疫苗可能进一步对病毒施加选择压力,使其进化为疫苗耐药毒株。”
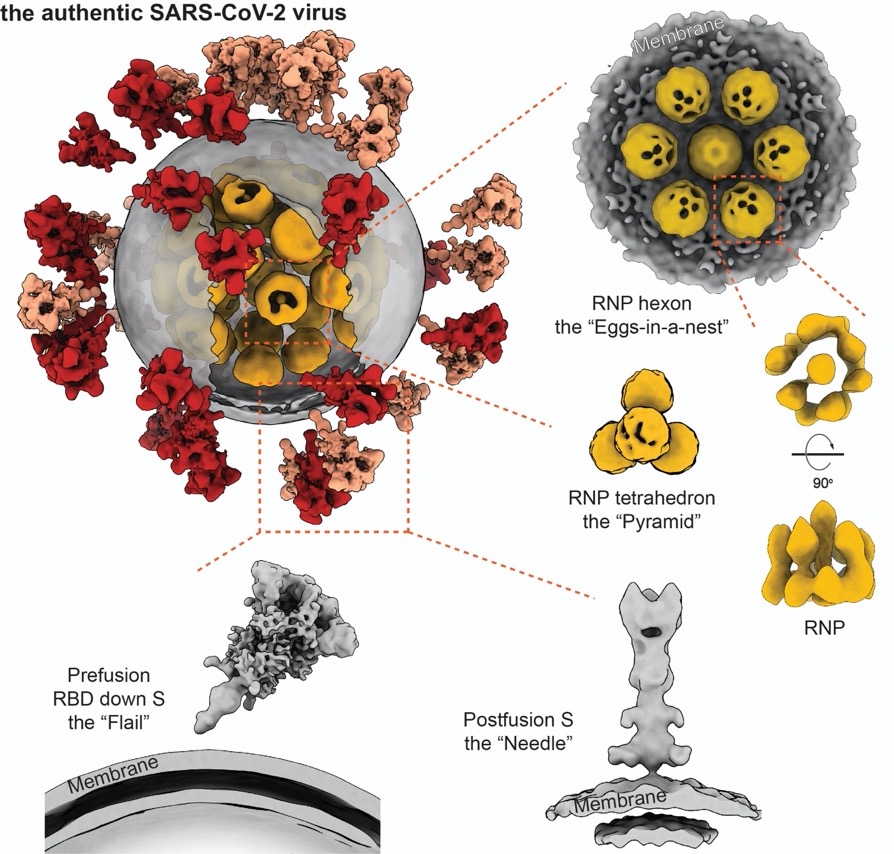
全球首个揭示新冠病毒全病毒三维精细结构及核糖核蛋白复合物的分子组装。图片来源:浙江大学医学院附属第一医院传染病诊治国家重点实验室李兰娟院士等人论文“Molecular architecture of the SARS-CoV-2 virus”。
变异:RNA病毒“天性”
截至2020年12月30日,世卫组织六个区域中已有五个区域的其他31个国家和地区发现了新冠B.1.1.7变体。
新冠病毒是β冠状病毒属成员,属于其中一个亚属Sarbecovirus属,其基因组序列是具有29903个碱基的正链RNA(ss-RNA)。
病毒依赖于宿主实现其增殖与传播。病毒首先入侵宿主细胞,在被感染细胞内实现病毒基因组的复制,进而产生病毒基因组的大量拷贝,用于生成新的子代病毒,再对新的宿主细胞进行感染。
根据美国病毒学家、诺贝尔生理学或医学奖得主David Baltimore提出的病毒分类,包括新冠病毒在内的冠状病毒属于正链RNA病毒,也就是说病毒的基因组RNA可以直接作为mRNA进行病毒蛋白质的翻译合成,病毒基因组先合成出负链RNA,再以其为模板合成出子代的正链基因组RNA。
值得一提的是,病毒聚合酶(polymerase)在病毒基因组复制和转录中起核心作用,RNA病毒则利用RNA依赖性RNA聚合酶(RdRp)复制和转录其基因组。而RNA容易突变的原因即在于RdRp不具有核酸酶校对活性,因此其基因组在复制过程中核苷酸的错配率就比较高。
近日在北京举行的2020未来科学大奖周“病毒与人类健康”主题论坛上,中国医学科学院-北京协和医学院副院长王健伟针对病毒的变异也作出类似解释,“这个聚合酶没有校错的能力,所以它会产生很多的错误,使得病毒存在多样性。”
在前后两任中科院武汉病毒研究所所长胡志红、陈新文主编的《普通病毒学》一书中,病毒的突变率通常定义为在病毒的每个复制周期中,病毒子代基因组中产生核苷酸突变的平均数。他们提到,与其他生物体相比较,病毒具有很高的突变率。一般来说,RNA病毒每10^3-10^7个核苷酸中就会出现一个错误碱基,而DNA病毒突变率相对较低,没10^9-10^10个核苷酸会发生一次这样的错误。
实际上,作为RNA(核糖核酸)病毒中的一种,人们对新冠病毒的突变无需感到惊讶,“它自己在复制过程中的复制机器就没有像人类基因复制那么准确,这是RNA病毒的一种‘天性’。”张林琦表示。
值得注意的是,和新冠病毒一样,艾滋病毒(HIV)也属于RNA病毒,但其属于RNA病毒中突变率更高的逆转录病毒。正因如此,在此次COVID-19大流行中,出于对病毒突变的高度敏感性,全球知名的艾滋病毒研究团队更早监测起新冠病毒在发生什么变化。
知名的美国洛斯阿拉莫斯国家实验室(Los Alamos National Laboratory)在疫情发生后不久即开始追踪新冠病毒的突变。洛斯阿拉莫斯国家实验室的计算生物学家Bette Korber,此前主要研究艾滋病病毒的分子生物学和种群遗传学,为获得有效的艾滋病毒疫苗作出了重大贡献。在COVID-19疫情后不久,她即率领团队和其他实验室合作,2020年4月,这支研究团队率先在预印本平台bioRxiv发表研究,报告早在2个月之前即发现D614G突变病毒(刺突蛋白上第614位氨基酸由天冬氨酸(D)变成了甘氨酸(G)),该毒株最终席卷全球。
Korber等人最终于2020年7月经同行评议正式发表在顶级学术期刊《细胞》(Cell)上的研究显示,携带S蛋白D614G的SARS-CoV-2突变株已成为全球大流行中最普遍的形式,相比突变前,更高的病毒载量提示D614G突变病毒和患者上呼吸道病毒核酸水平较高相关。但论文同时指出,“我们发现D614G和疾病严重程度之间没有显著关联。”
这次新发现的B.1.1.7突变毒株目前看起来有着类似结论。英国公共卫生部(Public Health England)于2020年12月30日公布的一项研究显示,虽然这一突变毒株在英国迅速传播,但似乎不会导致更严重的疾病。英国公共卫生部高级医学顾问Susan Hopkins进行了这项研究,她说,“这表明这种新的变异不会导致更严重的疾病或增加死亡率,但我们正在继续调查以更好地了解这一点。”
但科学家们同样强调,对新冠病毒的长期监测是一项必不可少的工作。“什么时候病毒变得完全逃离了这些潜在药物和疫苗的作用,这还需要长期的观察。”张林琦对澎湃新闻(www.thepaper.cn)表示。
新冠突变速度约为流感病毒的1/2,艾滋病毒的1/4
除研究新冠病毒在内的新发突发高致病性病毒外,张林琦长期重点研究艾滋病的致病机理,并研发抗病毒药物、抗体和疫苗。
张林琦对澎湃新闻记者表示,“从现在看,相比艾滋病毒和流感病毒,新冠病毒的突变率是相对比较低的。”有研究显示,典型的新冠病毒每月在其基因组中只积累两个单碱基突变,其突变速度约为流感病毒的1/2,艾滋病毒的1/4。
伦敦大学学院计算遗传学家Lucy Van Dorp在2020年9月曾对《自然》杂志表示,从世界上任何地方收集两种新冠病毒,在29903个RNA碱基中平均只有10个不同。
在张林琦看来,我们看到病毒突变的原因至少有两个方面。“一个是它自己在复制过程中的复制机器就没有像人类基因复制那么准确,所以它是一种天性,这是RNA病毒的一种天性;另外就是它复制出来的这些突变经过我们人体的选择之后才能被我们呈现和检测到。”
实际上,B.1.1.7突变毒株并非首次引发外界关注的新冠病毒突变。上述世卫组织的通报中显示,2020年1月底至2月初,新冠病毒出现D614G突变,随后逐渐取代了最初发现的毒株。到2020年6月,该变体成为全球范围内主要传播的新冠病毒类型。
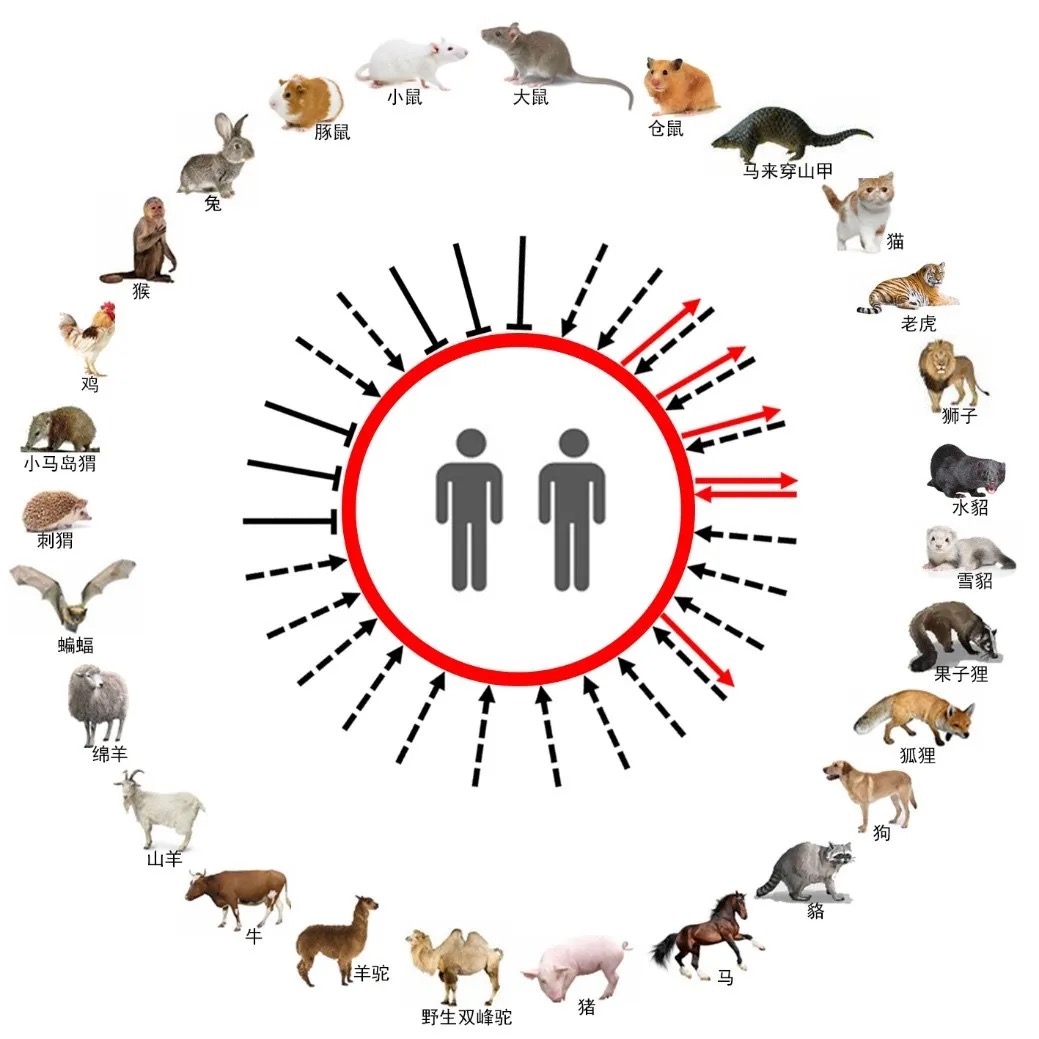
SARS-CoV-2 的潜在中间宿主。图片来源:中科院微生物所。
2020年8至9月,丹麦发现一种与水貂相关的新冠病毒变体,被丹麦相关部门命名为“Cluster 5”,具有此前未曾观察到的变异。根据丹麦进行的初步研究,令人担忧的是,该变体可能减少自然感染或接种疫苗后所产生的免疫保护的范围和持续时间,相关评估仍在进行。但目前丹麦仅在9月发现了12例人体感染此变体的病例,该变体似乎并未广泛传播。
而在英国报告突变毒株之后,2020年12月18日,南非检测到一种新冠病毒变体,出现了N501Y突变,南非将其命名为501Y.V2变体,该变体正在南非三个省中迅速传播。尽管此前英国发现的变异新冠病毒也有N501Y突变,但分析表明其与南非发现的变异新冠病毒是不同的变体。截至2020年12月30日,南非以外已有四个国家发现了该变体。
突变意味着什么?
突变是一件必然发生的事情,对科学家而言,他们更关心的是新冠病毒的突变对疾病和这场疫情的走向产生什么影响?科学家总是在尝试读懂这些突变,但分析突变影响的速度总是比发现突变的速度慢很多。
著名病毒进化学家、美国斯克里普研究院Kristian Andersen副教授从早期疫情暴发到持续的大流行,就一直在密切关注新冠病毒的基因组。澎湃新闻(www.thepaper.cn)记者2020年11月参加了一场学术会议,他表示实际上新冠病毒个体的变异是比较低的,有部分观点认为它的演化是比较慢的,“但问题是它可以在宿主之间进行重组,最后导致其演化速度越来越快,我认为从某些方面看它变异是低的,但从另外一些方面看它变异又是高的。”
S蛋白D614G突变被认为是适应性成功的典范,它仍是目前全球大流行的主导毒株。但在Korber等人公布结论时,仍引发了领域内科学家的广泛讨论,在预印本发表之际,即有质疑者提出,现在就判断任何一种毒株更具传染性都为时过早。
一些人甚至提出,D614G突变病毒株之所以传播得如此之深远和广泛,是因为它恰好感染了在大流行最初阶段没有采取措施的地区。或许研究者还需要做更多的工作来确定是否有任何毒株比其他毒株更具传染性,以及确定病毒的变异速度是否可能超过疫苗的研发速度。
就在Korber等人将研究成果经同行评议后发表在《细胞》时,来自耶鲁大学公共卫生学院、哈佛大学公共卫生学院、哥伦比亚梅尔曼公共卫生学院的三位学者也同期在《细胞》杂志则发表了另一篇文章,对这项研究作出点评。这三位学者提到,Korber等人的新研究是这场争论的核心。“他们提供了令人信服的数据,表明大流行早期出现病毒S蛋白D614G出现了氨基酸变化,而携带G614的病毒现在在世界各地占据主导地位。”但他们提出,关键的问题是:这是否是自然选择的结果,以及这对COVID-19大流行意味着什么?
对于最新引发担忧的B.1.1.7突变毒株,科学界的态度基本和此前类似:密切关注,但谨慎看待突变带来的影响。
姜世勃在接受澎湃新闻(www.thepaper.cn)记者采访时表示,由于B.1.1.7谱系包含的突变可能对病毒的传播性、致病性和/或毒力有一定程度的影响,目前有3个主要的问题需要研究与解决:
第一,确定B.1.1.7是否比野生型新冠病毒有更高的致病性和毒力?目前B.1.1.7在英国的快速传播是否和其传播性变化有关?
第二,我们需要检测这些突变株对已经紧急使用和还在临床试验中的疫苗及抗体的敏感性。
第三,全球应密切地监控现在正在发生突变或未来可能会发生的重大突变,提前做好应对准备。
根据爱丁堡大学的Andrew Rambaut、伯明翰大学的Nick Loman、格拉斯哥大学病毒研究中心David L Robertson等10位科学家代表英国COVID-19基因组学联盟(CoG-UK)在病毒学网站(virological.org)上传的新突变株序列及相关分析和结论,最早的2个B.1.1.7谱系的基因组样本于2020年9月20日在肯特郡采集,另一个于2020年9月21日在大伦敦采集。截至2020年12月15日,属于B.1.1.7谱系的有1623个基因组。在这些基因组中,519人在大伦敦,555人在肯特,545人在包括苏格兰和威尔士在内的英国其他地区,还有4人在其他国家。
这10位科学家提到,B.1.1.7谱系是在D614G突变株基础上发生突变,但其携带异常多的病毒基因变化。该毒株有23个特殊的突变,包括14个非同义突变(氨基酸改变)、3个缺失,此外还有6个同义突变(非氨基酸改变)。这是迄今为止首次在一个毒株上出现如此多的变异。
值得一提的是,B.1.1.7谱系的异常大量突变,其中有8个发生在“皇冠”刺突蛋白中,包括69-70缺失、145缺失及N501Y、A570D、D614G、P681H、T716I、S982A、D1118H突变。刺突蛋白负责与受体结合入侵宿主细胞,被比作是最关键的入侵“钥匙”。
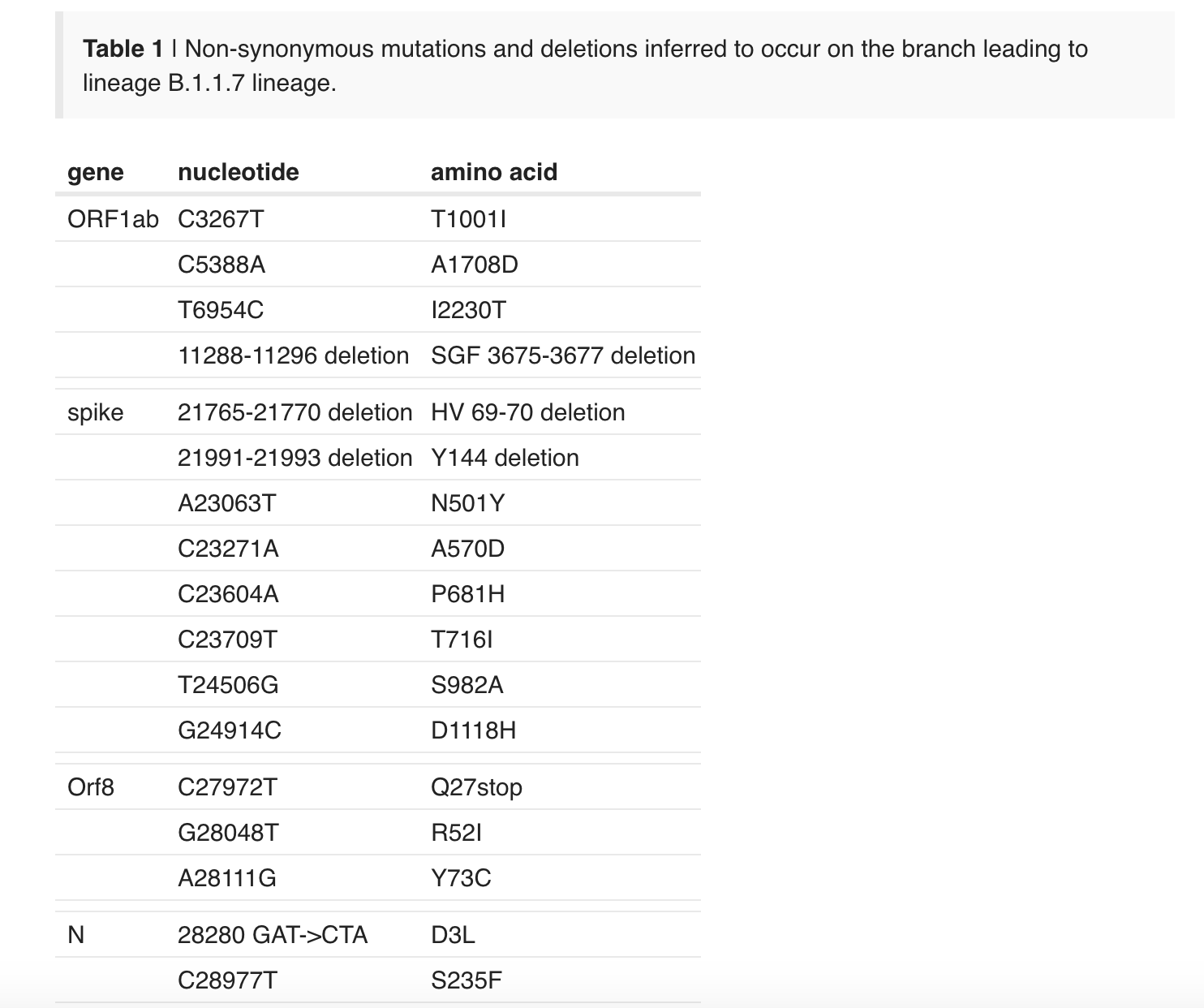
B.1.1.7谱系的异常大量突变。
Robertson等人写道,其中3个突变具有潜在的生物学效应,这些效应之前也也被描述过。第一,N501Y突变是受体结合域(RBD)内6个关键接触残基之一,已被鉴定为增加与人和鼠ACE2的结合亲和力。科学家也据此推测,B.1.1.7毒株传染性提高70%,极有可能与N501Y突变有关。
第二,69-70缺失,这会导致刺突蛋白69-70位的两个氨基酸缺失,这一突变是在刺突蛋白N端区域观察到的缺失之一,在多个RBD相关突变谱系中发现。例如,丹麦水貂突变体中同样存在69-70缺失。研究发现,这种突变可能有利于病毒逃逸宿主的免疫反应,或有利于病毒逃逸宿主的免疫反应。
第三,P681H突变紧邻furin裂解位点,这是一个已知的具有生物学意义的位点。此前的研究显示,新冠病毒的S1/S2 furin裂解位点在其他密切相关的冠状病毒中并未发现,被认为可促进病毒进入呼吸道上皮细胞并在动物模型中传播,这也被认为是新冠病毒传播性更强的关键。
了解突变信息后不难发现,相比D614G的单碱基突变,B.1.1.7毒株的突变更像是一场多重效应的“大杂烩”,这会不会促使毒株发生系统性变化?
前述英国公共卫生部的研究显示,研究人员将1769名感染了这种新型病毒的人与1769名感染了野生型病毒的人进行了比较。受试者的年龄、性别、居住地和测试时间匹配。有42人被送进医院,其中16人携带新的变种病毒,26人携带野生型病毒。12例变异病例和10例比较病例在检测的四周内死亡。研究认为,B.1.1.7变异毒株和野生型毒株的住院和死亡率的差异均无统计学意义。
研究人员还研究了可能的二次感染, 在初次感染后至少90天,变异组中只有2例二次感染,而比较组中有3例。
不过,研究人员也证实,B.1.1.7突变毒株比野生型更具传染性。在对英国国家医疗服务体系(NHS Test and Trace)的数据进行的另一项分析中,他们发现,与携带这种新型病毒的人接触过的人中,有15%感染了病毒,相比之下,与携带野生型病毒的人接触过的人中,只有10%感染了病毒。
伯明翰大学的另一项研究也证实了之前的科学建议,即B.1.1.7会导致上呼吸道中病毒载量更高,该研究尚未经同行评阅。该研究发现,在感染了这种新变种的患者中,有35%的测试样本中病毒载量非常高,而在没有这种变种的患者中,这一比例为10%。
张林琦对澎湃新闻(www.thepaper.cn)记者表示,这些突变株从现在的情况来看没有增强致病性的现象,但可能增加了传播的能力,“我们不能低估潜在的风险,所以对这类病毒进行持续性的监测、基因的分析和毒力的监测。”
疫苗还能终结疫情吗?
全球的实验室仍在继续研究病毒突变对传播和致病性产生的影响,与此同时,外界需要迫切了解的是:现行临床使用或在研的药物和疫苗还有效吗?
Andersen在前述学术会议上即强调,“我们需要意识到,一些疫苗在选择病毒的时候可能会出现意外。”Andersen当时以水貂来举例,“病毒传播到水貂之后,很快就适应并演化。”
在上述学术会议上,澳大利亚墨尔本大学Kanta Subbarao教授也从Andersen谈及的病毒变异角度谈及疫苗。她当时表示,从流感疫苗来看,选择毒株很重要,“新冠疫苗目前还是一个挑战,我们面临很大的压力。”她建议,在进行全球病毒监测和全球流感监测的同时,应同时有平行体系来监测冠状病毒的进化,“然后才能生产出最先进的及时的疫苗。”
但也有学者认为不必过分担忧。在D614G突变毒株广泛讨论之际,哈佛大学陈曾熙公共卫生学院的Bill Hanage博士就表示,单点突变不太可能产生重大影响。Hanage写道,重要的是要记住,任何药物或疫苗都要经过测试,以对抗正在传播的任何一种病毒。“病毒能这么早地在所有这些疫苗上找到逃逸突变,那就太幸运了。”
张琳琦对澎湃新闻(www.thepaper.cn)记者表示,“从我们现在有的一些抗体药物和疫苗诱导出的免疫反应,都对这些突变株维持很高的抗病毒能力,所以大家不用特别的担心。”但他同时强调,“当然什么时候病毒变得完全逃离了这些潜在药物和疫苗的作用,这还需要长期的观察。”
中国科学院微生物研究所研究员严景华在上述2020未来科学大奖周“病毒与人类健康”主题论坛上表示,可能很多人都在关心,病毒很容易变,疫苗现在研发的到底行不行?“至少从目前来讲,尽管新冠病毒也是RNA病毒,但现在通过灭活病毒免疫出来的抗体,对于不管是最早的病毒,还是现在在欧洲、美洲流行的病毒,它们都是可以中和的,至少现在是这样。”
她提到,至于说几年以后有没有突变的更多?“可能要等到几年以后才有结论。”
复旦大学附属华山医院感染科主任张文宏则认为现在谈变异对疫苗的逃避还为时尚早。他在上述主题论坛上表示,“我个人认为,在疫苗出来之前,血清型出现漂移的概率是比较低的。到目前才有几个月的时间,没有任何选择性压力、没有形成人群的免疫之前,这个血清型是不会改变的,这种血清型的改变一定是要人群当中出现了大量的群体免疫之后,才会造成血清型的漂移。”
他还提到,“血清型漂移之后,也未必导致疫苗接种无效。”张文宏强调,“疫苗还没有出来,我们老是谈变异对疫苗的逃避,我觉得毫无意义。”
有科学家也持同样的观点,在这个地球上几乎每个人都易受感染的时候,病毒可能没有什么使自己变得更易传播的进化压力,因此,即使是潜在有利的突变也可能不会迅速发展。Hanage认为,“就病毒而言,接触到的每个人都是一块‘好肉’,没有比这个更好的选择了。”
张文宏同时表示,疫苗出来以后,谈选择性压力下的疫苗漂移,“我觉得这点意义才比较重大。”
但值得注意的是,疫苗也并非脆弱得不堪一击,就像人体的自然免疫反应一样,疫苗往往会诱导一系列的抗体。国药集团中国生物技术股份有限公司董事长杨晓明在前述主题论坛提到这一问题,“现在做出来的疫苗,不同的工业路线都有不同的特点。举个例子,病毒灭活疫苗,全病毒灭活以后作为抗原做的,抗原相对完善,蛋白重组疫苗,是要选择高发的、非常有用的表位去做疫苗,还有mRNA疫苗,这些疫苗的工艺路线不一样,特性各有千秋。”
杨晓明表示,从广谱覆盖来讲,变异有从基因型上变异的,也有从表型上变异的,到现在我们发现的在国内分析到的病毒,大概不同地区十几株不同的病毒株都可以中和,“说明目前的变异不足以导致现在做出来的疫苗无效。”
相比疫苗,科学家们更担心,如果不明智地使用抗体疗法,突变可能变得更加常见,因此抗体“鸡尾酒”疗法可能会减少这种突变几率。此前,军事医学科学院陈薇院士等人也都尝试在新冠康复患者的血浆浆中分离并鉴定新的单克隆抗体(mAbs),以期助力“鸡尾酒”疗法,避免将来的病毒逃逸突变。
中国疾控中心主任、中科院院士高福团队也在寻找有效的中和抗体。2020年5月,澎湃新闻(www.thepaper.cn)记者曾报道了高福等人发表的一项研究,他们从一名中国康复患者中分离出四种人源单克隆抗体,在体外均显示中和能力,其中2种抗体尤其具有潜力。
高福等人在论文中同样写道,“鸡尾酒”抗体应考虑作为一种替代治疗策略,以避免潜在的逃逸突变。“随着新冠疫情的持续蔓延,对病毒RBD蛋白表位的鉴定至关重要,这将为开发疫苗提供有价值的信息。此外,针对表位的中和抗体的分子特征有助于小分子或肽药物/抑制剂的开发。”
张林琦对澎湃新闻(www.thepaper.cn)记者总结其眼下观点为,“从我们现在的状态来说,应该战略上藐视这些突变,但是战术上一定要重视这些突变,对它的传播效率、致病性以及我们手中的抗病毒抗体和疫苗的有效性方面,我们要随时进行评估,也许将来需要进行调整。”
姜世勃也同样强调,“提前开发出高效、广谱、安全的抗冠状病毒疫苗、抗体和药物是应对病毒突变和新发冠状病毒疫情的最佳策略。”
世卫组织方面表示,如果病毒变化很大,病毒变体与疫苗或检测试剂所针对的病毒已不同,就可能会影响疫苗和诊断试剂效果。世卫组织及其专家网络正在监测SARS-CoV-2的变化,以便在出现这种情况时采取措施,防止此种变体的传播。“到目前为止,SARS-CoV-2的变化很小,对目前正在开发的诊断工具、治疗方法和疫苗没有影响。”





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




