- +1
美国抗疫重大里程碑:FDA正式批准辉瑞疫苗紧急使用授权申请
原创 JACKZHAO MedSci梅斯
导语:美国FDA正式批准辉瑞和BioNTech的新冠疫苗紧急使用授权(EUA)申请。
12月11日,美国FDA 正式批准辉瑞疫苗(BNT162b2)紧急使用,第一批共290万剂疫苗将从下周一起开始运送至美国各地,成为美国抗疫进程中重大里程碑。


美国推特FDA及网站截图
这一决定,美国成为对该疫苗进行紧急使用授权的第六个国家,此前为英国、巴林、加拿大、沙特阿拉伯和墨西哥。预计将在数周内获得包括欧盟在内的其他国家与地区授权。
紧急使用授权(EUA)含义是指,FDA授予该医疗产品的特殊授权,可在紧急情况下使用但尚未完全批准。辉瑞公司必须为其疫苗单独提交一份申请,以得到FDA的完全许可。
FDA官网发布的声明指出,确定批准辉瑞-BioNTech新冠疫苗是因为其已符合签发EUA的法定标准。有数据证明辉瑞-BioNTech 新冠疫苗可能有效预防新冠肺炎。数据还支持已知和潜在的利益大于已知和潜在的风险,从而支持疫苗在16岁及以上的数百万人中使用,包括健康个体。在做出此决定时,FDA可以向公众和医学界保证,它已经对可用的安全性,有效性和制造质量信息进行了彻底的评估。

Stephen M. Hahn推特截图
FDA局长Stephen M. Hahn表示:“今天的行动遵循公开透明的审查程序,其中包括来自独立科学和公共卫生专家的意见,并由该机构的职业科学家进行了全面评估,以确保该疫苗符合FDA的安全性、有效性和制造质量标准,以支持紧急使用授权。以预防新兴疾病威胁,这是对全球科学创新和公私合作的真实证明。”

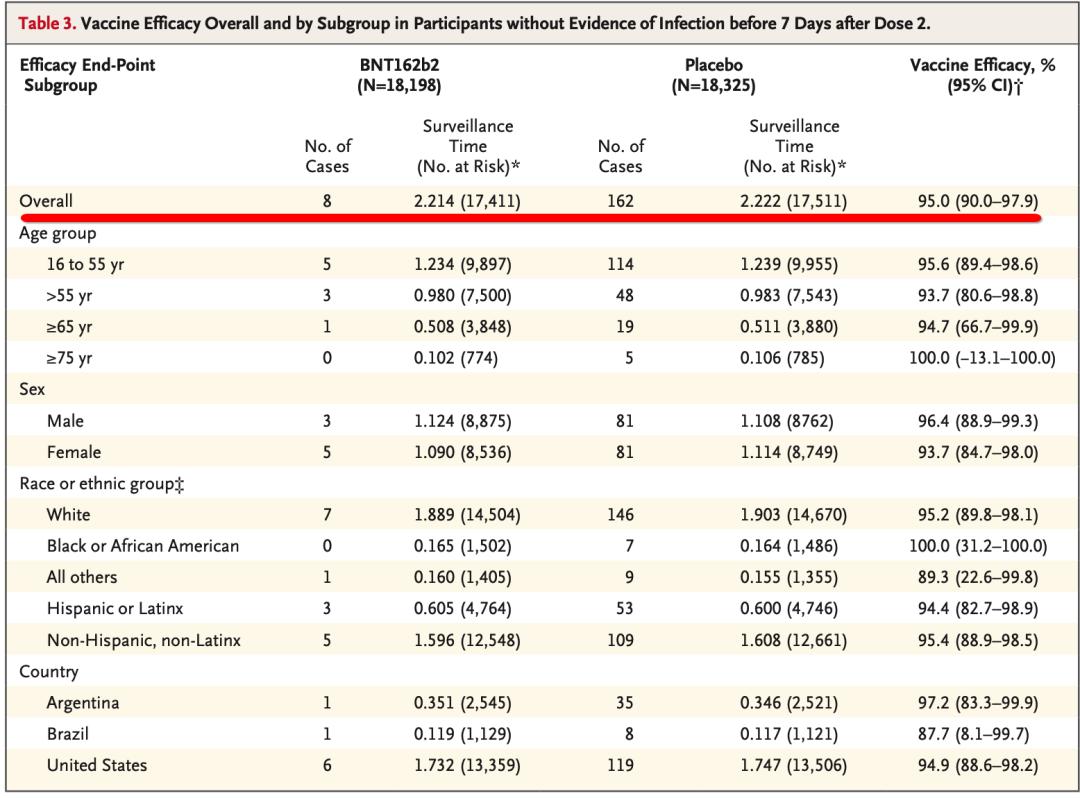
总体与亚组疫苗保护效力情况,Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine,DOI: 10.1056/NEJMoa2034577
该决定是辉瑞及其德国合作伙伴BioNTech的胜利,后者在11个月前就开始研发这款疫苗。疫苗通常需要数年才能开发出来。该公司的后期临床试验招募了近44000人,被发现有95%的有效率。
此前一天,疫苗和相关生物制品咨询委员会(Vaccines and Related Biological Products Advisory Committee)的投票结果为17票赞成、4票反对、1票弃权通过辉瑞公司针对16岁及16岁以上人群使用的疫苗,该机构计划在周六发布正式授权。

美国总统特朗普推特截图
但在特朗普总统因未能更快地批准疫苗而攻击哈恩博士之后,该时间表缩短了半天。但是,加速的公告预计不会加快全国疫苗的交付。特朗普周五星期五在推特上对FDA局长Stephen M. Hahn写道,在“我的推动”下,政府已将疫苗开发工作缩短了数年。“现在该拿出疫苗了!” “停止玩游戏,开始挽救生命!!!” 特朗普总统此前也一再指责美国FDA以及制药商们,缓慢进行审批程序,以便从政治上伤害他。

辉瑞疫苗如何运输,CNN
据《纽约时报》报道,辉瑞公司已与美国政府达成协议,将在明年3月前提供1亿剂这种疫苗。根据该协议,这些疫苗将免费向公众提供。
随着疫苗剂量在美国全国范围内分配,各州和地方官员将监督疫苗在各州以及物流中的分配,并且优先考虑卫生保健工作者和长期护理设施的居民。
在大多数情况下,首批疫苗将从辉瑞位于密歇根州卡拉马祖的工厂运输到医院系统和药房。据CNN报道,各州已制定了个性化的疫苗分配计划,该计划随每个州的人口和地理需求而略有不同。美国CDC疾病预防控制中心的官员一直与州领导人保持密切联系,以了解他们的分配计划将如何运作以及可能导致州与州之间出现挑战。
原标题:《美国抗疫重大里程碑:FDA正式批准辉瑞疫苗紧急使用授权申请》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。




- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




