- +1
肠道菌群新功能,触发人体免疫防御机制,帮助人体抵御病毒感染
原创 生物世界 Bio生物世界 收录于话题#肠道菌群5个

编辑 | 王聪
排版 | 水成文
人类和其他哺乳动物一样,身体被包括细菌、病毒和真菌在内的数万亿微生物占据,这些微生物被统称为共生菌群。从某种意义上来说,“人”是一个由人体和共生菌群的多元复合体。
更重要的是,共生菌群并非一成不变,在成长过程中,我们经历了不同的环境,遇到了不同的人,我们体内的共生菌群也随之不断变化,大量的肠道微生物组学研究表明人体共生菌群能在一定程度上影响着我们的健康、体质、性格甚至思维。
2020年11月18日,哈佛医学院的研究人员在国际顶尖学术期刊 Cell 杂志上发表题为:Commensal Microbiota Modulation of Natural Resistance to Virus Infection 的研究论文。
这项研究首次在小鼠模型上描述了肠道细菌是如何帮助抵御病毒感染的。研究团队发现并确定了一组肠道微生物可以触发免疫细胞释放排斥病毒的Ⅰ型干扰素。并进一步鉴定了一种位于细菌外膜的多糖A(PSA)可以开启机体的免疫保护级联,而这种分子或将成为增强人类抗病毒免疫的药物的基础。

调节细胞因子信号是共生菌群调节宿主免疫系统的一种关键机制。其中,Ⅰ型干扰素(IFN-Is)是一类结构相似的细胞因子,并参与机体对病毒感染的反应。事实上,IFN-Is可以诱导感染细胞的凋亡、调节对抗病毒反应至关重要的免疫细胞亚群,从而在大多数病毒感染的反应中发挥了关键作用。
十分有趣的是,在出生后不久,人体就能在没有主动感染的情况下提供抗病毒保护的低水平干扰素信号,但是种信号在哪里发生以及如何发生仍然是个谜。
如今,这项研究却表明,这种保护反应来自驻留在结肠壁上的免疫细胞和一类肠道共生菌的相互作用。
在这项研究中,研究人员在一系列实验中发现,脆弱拟杆菌(Bacteroides fragilis)——一种存在于大多数人类胃肠道中的共生菌,它可以有效地启动免疫保护信号级联,诱导结肠中的免疫细胞释放干扰素-β(IFN-β)。
IFN-β是机体内重要的一类细胞因子,可通过干扰病毒RNA或DNA复制而抑制病毒生长,同时还能刺激免疫细胞并增强其杀伤力,诱导感染病毒的细胞的自我毁灭。
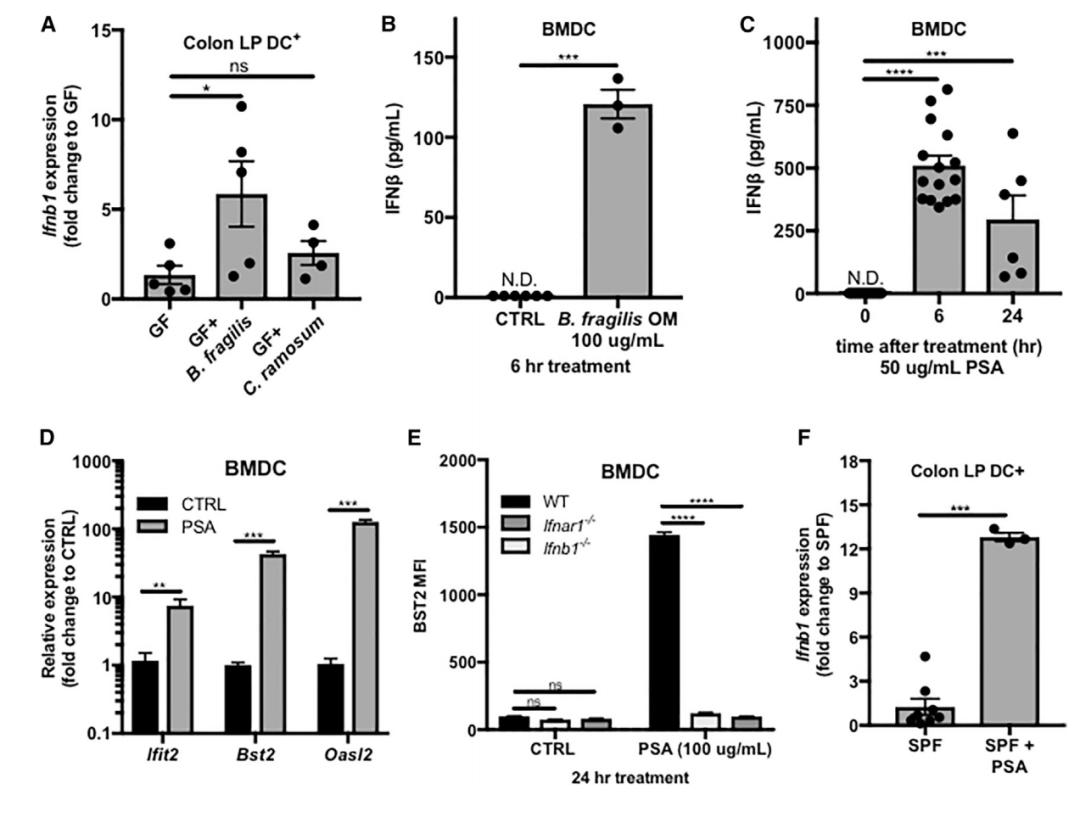
为了确定脆弱拟杆菌是否能保护动物免受感染,研究小组测试了两组小鼠——一组使用抗生素去除其肠道菌群,另一组则保留完整的肠道菌群。
研究团队使用水疱性口炎病毒(VSV)感染两组小鼠,他们发现保留完整的肠道菌群的小鼠相比另一组,被感染的可能性更低,且感染后症状更轻。
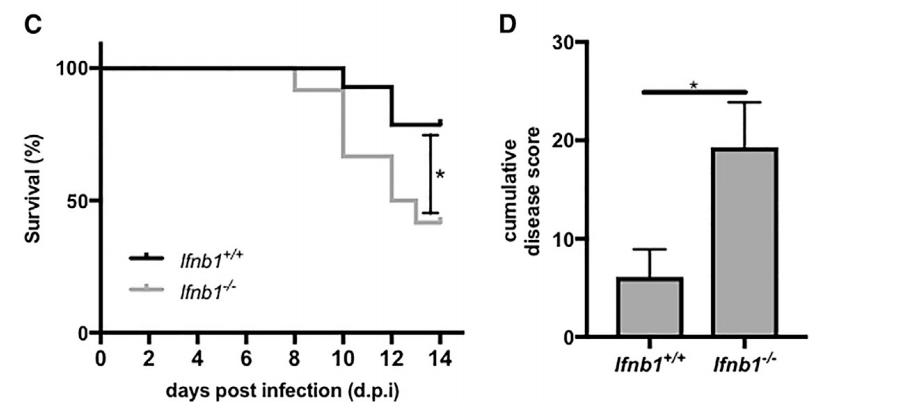
研究团队进一步发现,脆弱拟杆菌可以通过其外膜上的多糖A与结肠免疫细胞的TLR4-TRIF受体相互作用,激活免疫保护信号通路,进而促进抗病毒干扰素的分泌。具体来说,当免疫细胞表面的蛋白受体识别出各种感染性病菌表面的特定分子模式,并通过9种toll样受体途径中的一种,对这些入侵者进行免疫防御时,该通路被有效激活。
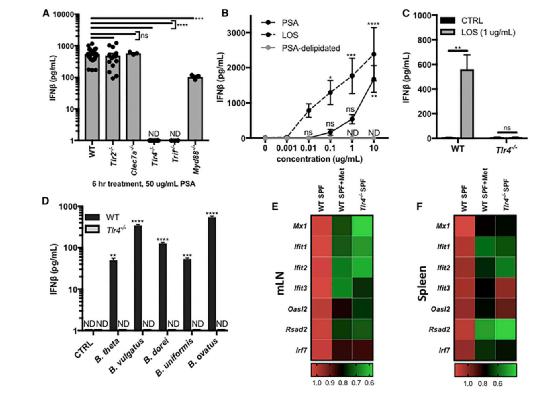
鉴于这类可以触发免疫级联反应的细菌外膜表面分子并不只存在于脆弱拟杆菌中,研究人员还测试了携带这种分子的其他种类细菌是否也能促发类似的免疫信号。结果表明,拟杆菌属的多种细菌均可以成功启动类似的免疫级联反应。
这一发现表明,肠道菌群中存在一个十分广泛的、可引起宿主免疫保护信号级联的分子机制。对此,研究人员表示:“这些发现表明,通过TLR4信号传导来诱导IFN-分子并不局限于脆弱拟杆菌,其他类似的共生菌也可能具有这种功能。”
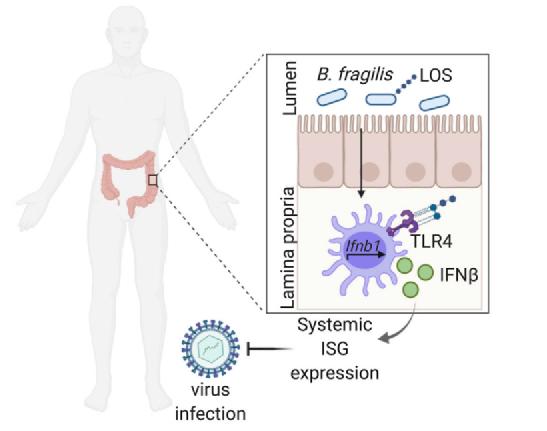
总而言之,这项研究发现,存在于脆弱拟杆菌等肠道共生菌外膜上的一类分子可以有效刺激驻留在结肠壁上的免疫细胞,激活免疫保护信号通路,进而促进抗病毒干扰素的分泌,从而保护机体免受病毒感染。
更重要的是,正如研究的通讯作者 Dennis Kasper 教授所说的:“考虑到干扰素在疾病和健康的关键作用,这项研究发现肠道共生菌可以诱导干扰素保护信号,从而指向一个十分有前景的新方法来开发可以增强病毒免疫反应、减少病毒感染的风险的治疗性药物!”
论文链接:
https://doi.org/10.1016/j.cell.2020.10.047
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




