- +1
特朗普亲测有效的再生元新冠鸡尾酒疗法获FDA紧急使用授权
原创 JACKZHAO MedSci梅斯
导语:REGEN-COV2是首个获得FDA紧急使用授权的COVID-19抗体鸡尾酒疗法。

今天,美国食品和药物管理局(FDA)宣布向一种为治疗新冠肺炎患者而开发的全新药物颁发紧急使用授权(EUA)。
该疗法是由再生元制药(Regeneron)研发的名为REGEN-COV2的两种单克隆抗体(casirivimab和imdevimab,也称为REGN10933和REGN10987)的鸡尾酒疗法,专门设计用于阻断SARS-CoV-2感染。
用于治疗成人和儿童患者(12岁或以上且体重至少为40kg)的轻至中度新冠肺炎患者,并具有直接SARS-CoV-2病毒检测的阳性结果,并由可能发展为严重新冠肺炎的高风险。这包括年龄在65岁以上或患有某些慢性病的人。

在对新冠肺炎患者进行的一项临床试验中,与安慰剂相比,在治疗后28天内,具有高疾病进展风险的患者合用casirivimab和imdevimab可以减少与新冠肺炎相关的住院或急诊就诊。但仍然需要进一步评估该疗法用于治疗新冠肺炎的安全性和有效性。
FDA声明指出,对于Casirivimab和imdevimab的本次授权并不适用于因新冠肺炎而住院或因新冠肺炎而需要通气氧疗的患者。因在新冠肺炎住院患者中尚未显示出casirivimab和imdevimab治疗的益处。当向住院的需要高流量氧气或机械通气的COVID-19患者施用时,单克隆抗体(例如casirivimab和imdevimab)的使用可能与较差的临床结局有关。Casirivimab和imdevimab必须通过静脉(IV)输注一起给药。
美国FDA局长斯蒂芬·哈恩 (Stephen Hahn)指出,在这场史无前例的大流行中,FDA仍然致力于促进国家的公共卫生。FDA授权这些单克隆抗体疗法可帮助门诊患者避免住院,并减轻我们医疗保健系统的负担,FDA运用了所有可能的途径进行新的治疗在继续研究这些治疗方法的安全性和有效性的同时,尽快向患者提供。
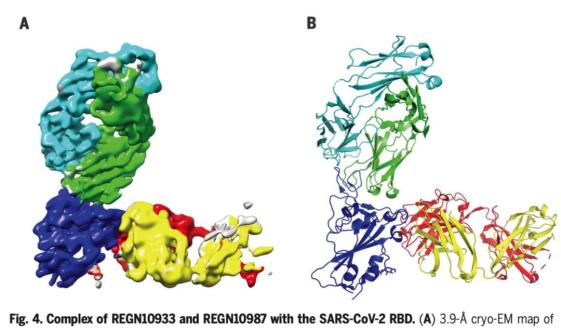
为了开发REGEN-COV2,Regeneron的科学家评估了该公司VelocImmune®小鼠产生的数千种全人类抗体,这些小鼠已经过基因改造,具有人类免疫系统,以及从新冠肺炎康复者中鉴定出的抗体。形成REGEN-COV2(Casirivimab和imdevimab,即REGN10933和REGN10987)的两种有效的病毒中和抗体非竞争性地与病毒刺突蛋白的关键受体结合结构域结合,从而削弱了突变病毒逃避治疗的能力并防止人类中出现突变,阻止病毒附着和进入人体细胞,详情参见Regeneron发表的两篇《科学》论文。


需要指出的是EUA的签发不等同于FDA的正式批准。在确定是否签发EUA时,FDA将评估所有可用的科学证据,并仔细权衡紧急情况下使用的产品的任何已知或潜在风险与任何已知或潜在利益。FDA颁发此次授权说明,该机构已确定有理由相信,联合使用casirivimab和imdevimab可以有效治疗轻度或中度COVID-19的患者。
支持该caarivrivimab和imdevimab的EUA的数据基于对799例轻至中度COVID-19症状的非住院成人进行的随机,双盲,安慰剂对照临床试验。在这些患者中,获得阳性的三天内,有266例接受了2400毫克casirivimab和imdevimab的单次静脉输注(每种1200 mg),267例接受了8000毫克 casirivimab和imdevimab的静脉输注(每种4000 mg),还有266例接受了安慰剂。
该试验的预定主要终点是病毒载量相对于基线的时间加权平均变化。在第7天,接受 casirivimab和imdevimab单抗治疗的患者的病毒载量减少量大于接受安慰剂治疗的患者。但是,最重要的证据表明 casirivimab和imdevimab单抗联合给药可能更有效,尤其是治疗后28天内的住院和急诊就诊。
对于疾病进展高风险的患者,接受casirivimab和imdevimab治疗的患者平均发生住院和急诊就诊的比例为3%,而接受安慰剂治疗的患者为9%。接受两种casirivimab和imdevimab单抗剂量的患者对病毒载量,住院减少和急诊就诊的影响相似。casirivimab和imdevimab可能的副作用包括:过敏反应和与输液有关的反应,发烧,发冷,荨麻疹,瘙痒和潮红。
美国总统特朗普此前被诊断出患有新冠肺炎后不久就采用了该实验性抗体治疗,并创造了“三天出院”的记录,但是否该疗法起决定作用尚未可知。礼来公司进行的类似抗体bamlanivimab(LY-CoV555)治疗也在本月初获得了FDA紧急授权使用批准。
迄今为止的证据表明,抗体治疗在疾病的早期阶段效果是最好的。与礼来公司的治疗方法一样,再生元也未获准用于住院或需要氧气的人。此前,礼来与再生元均一度在试验中停止了对住院患者的治疗,因为它表示似乎并没有帮助那些患者。
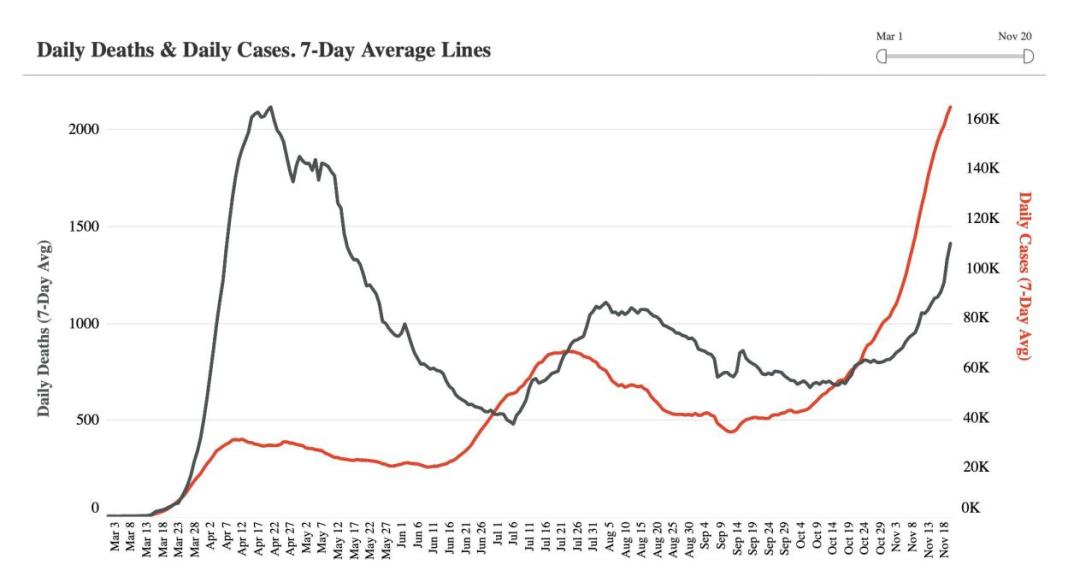
美国疫情近期持续加剧,住院患者人数创下新高,美国CDC预测美国累计新冠肺炎死亡病例数可能在三周后接近30万例。这给紧急授权提出了一个紧迫的问题,即谁将获得治疗,因为在美国平均每天平均有168000新增病例,而且美国诸多地区医院的病床已经耗尽,美国医疗系统超负荷运转医护人员临近崩溃的边缘。
再生元表示,到11月底为止,仅约能够提供80000人份改疗法药物,到1月的第一周,将达到200000人份,到1月底的,将有300000人份药物。再此之后,再生元将与罗氏(Roche)建立了合作伙伴关系,迅速提高抗体产量,增加REGEN-COV2的全球供应。一旦两家公司都在2021年达到满负荷生产,则预计每年将至少有200万剂治疗剂量。
据《纽约时报》报道,Regeneron已从联邦政府获得超过5亿美元的资金,用于开发和生产这种治疗方法,这是一个复杂且耗时的过程。尽管将免费提供前300000人份,但患者可能需要支付治疗费用,必须在诊所或医院中进行静脉注射。
抗体治疗疗法的关注程度明显低于新冠疫苗,但卫生官员长期以来一直希望,在新冠病毒疫苗得到更广泛的普及之前,它们可以作为桥梁。最近显示,辉瑞疫苗与Moderna公司生产的疫苗在早期分析中的有效性均超过90%。辉瑞公司已经完成了试验,已于周五提交了紧急授权疫苗的申请,Moderna表示也计划很快申请。尽管如此,仍需要几周的时间才能获得疫苗。
Regeneron获得紧急授权可能仍然具有意想不到的效果,使临床试验在证明不同年龄组的治疗效果中的作用变得更加复杂。如果该药物的使用范围更广,那么可能会更少的人希望注册进行临床试验,并冒着接受安慰剂的风险。
Regeneron的临床试验仍在继续进行中,2/3期临床试验中继续评估REGEN-COV2在某些住院和非住院患者中治疗新冠肺炎患者的情况,在英国住院患者的3期开放标签RECOVERY试验以及3期试验中用于预防感染者家庭接触新冠肺炎者。迄今为止,已有7000多人参加了REGEN-COV2临床试验。
喜欢此内容的人还喜欢
原标题:《特朗普亲测有效的再生元新冠鸡尾酒疗法获FDA紧急使用授权》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2025 上海东方报业有限公司




