- +1
假基因有真作用?科学家揭秘假基因全新调控机制
原创 Cell Press CellPress细胞科学

生命科学
Life science
2021年1月20日,中国医学科学院基础医学研究所余佳研究组、中国科学院动物研究所张勇研究组、中国医学科学院血液病医院(血液病研究所)石莉红研究组在Cell Press细胞出版社旗下期刊Developmental Cell上在线发表了题为“Genome-wide analysis of pseudogenes reveals HBBP1's human-specific essentiality in erythropoiesis and implication in β-thalassemia”的文章。该研究系统性地分析了假基因在人类多组织中的表达特征及与人类疾病的关联,揭示了位于人β-珠蛋白基因簇中的假基因HBBP1(又称η-globin)在红细胞发育中发挥人类特异的关键调控作用并进化出不依赖母源序列的崭新调控方式,提出人类特异表达的假基因可能参与人类特异性状演化的新概念,并发现起源方式不同的假基因在作用方式上存在巨大差异,为假基因功能机制研究提供重要参考。
长期以来,通过基因重复诞生新基因被认为是物种进化的主要驱动力。然而,大多数重复基因在演化过程中会积累各种功能丢失突变从而产生假基因(Pseudogene)(图1)。其数量巨大(占已注释人类基因模型的1/4),通常被认为不具有生物学功能。然而,随着技术进步,假基因的功能在疾病中(尤其肿瘤中)已被逐步揭示。但假基因在个体发育中的功能却知之甚少。
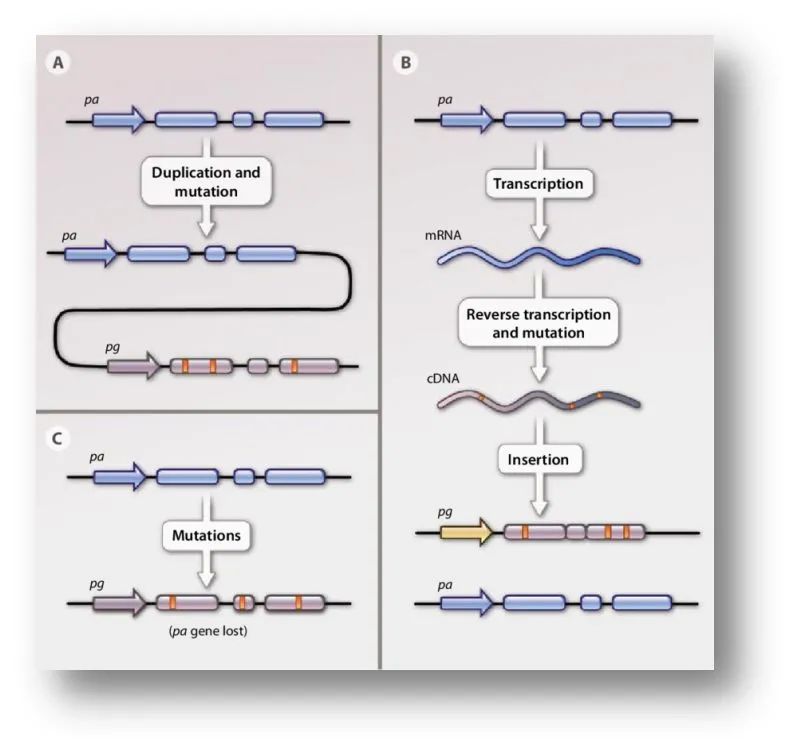
图1 假基因的不同起源(图片来源:Poliseno L. Sci Signal. 2012 Sep 18;5(242):re5.)
该研究工作首先在基因组水平上分析了假基因在人类多组织中的表达特征及与疾病的关联,发现位于β-珠蛋白基因簇中的假基因HBBP1的序列多态性与人类红细胞疾病密切相关。进一步的功能研究显示HBBP1是人红细胞发育成熟所必需,其缺失导致胚胎干细胞向红系分化能力的完全丧失,在造血干/祖细胞中下调其表达显著抑制体内、体外红细胞分化进程。机制探索发现HBBP1通过与红系发育关键转录因子TAL1 mRNA竞争性结合RNA结合蛋白hnRNPA1,提高TAL1 mRNA稳定性,维持红细胞正常发育。不仅如此,HBBP1在β-地中海贫血患者中亦具有重要保护作用,其在β-地中海贫血患者中会代偿性升高,通过促进TAL1表达参与患者体内HbF活化及贫血症状缓解。
最后,对假基因HBBP1的进化及在多物种中的表达分析发现,HBBP1虽然通过重复起源于有胎盘哺乳动物祖先,是一个古老的假基因,但在获得结合位点序列后的物种演化中呈现出复杂的多样性,仅在人红细胞中获得了大量表达,并参与到了TAL1-hnRNPA1调控网络中,发挥人类特异的重要功能。该工作阐释了一个假基因从产生到消亡,并再次获得新生,发挥物种特异调控功能的过程,使我们得以窥见自然选择、物种进化的精彩动态(图2)。
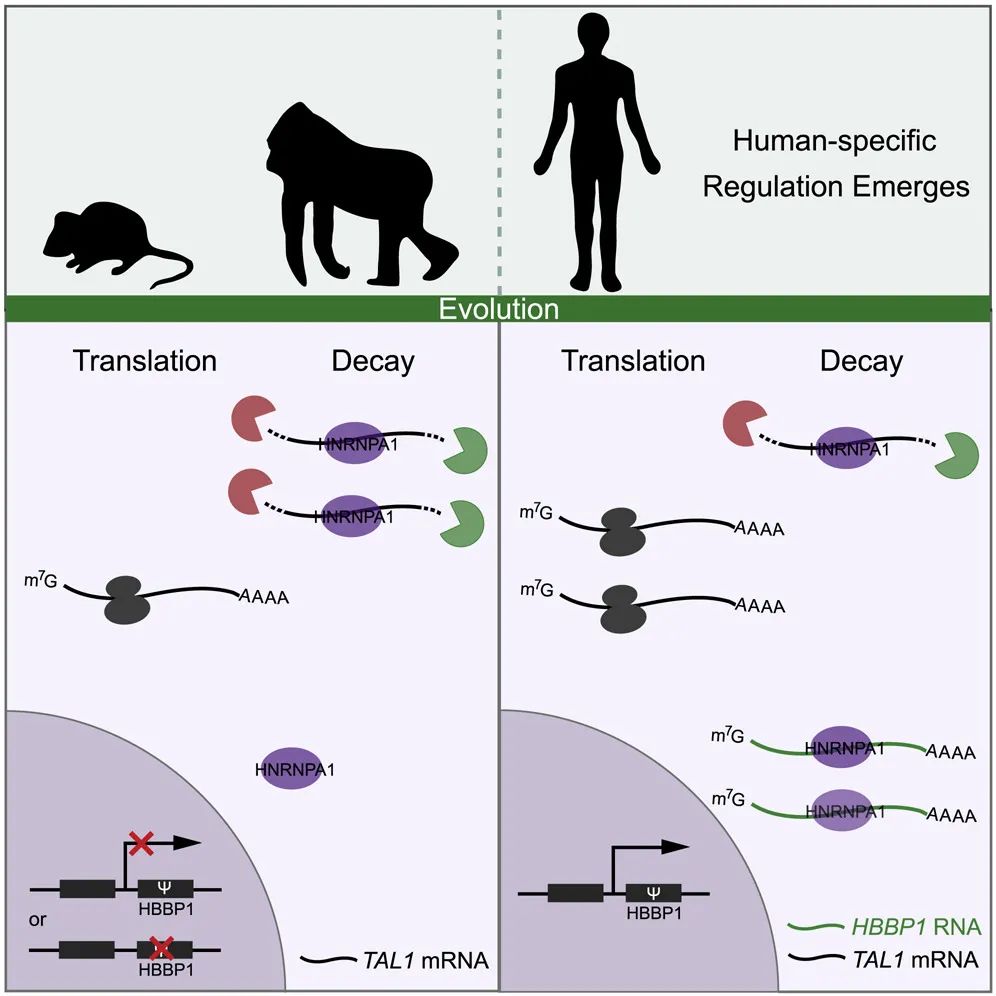
图2 假基因HBBP1进化及作用模式图
中国医学科学院基础医学研究所副研究员马艳妮、博士刘思琪,中国医学科学院血液病医院助理研究员高洁,中科院动物所博士陈春燕,汕头大学医学院第一附属医院张昕研究员为该研究论文的第一作者。余佳研究员、张勇研究员、石莉红研究员、马艳妮副研究员为该论文的通讯作者。
作者专访
Cell Press细胞出版社特别邀请论文通讯作者之一余佳研究员代表研究团队进行了专访,请他们为大家进一步详细解读。
CellPress:
首先,请您和您的团队和大家分享一下什么是假基因?
余佳研究员:
假基因(Pseudogene)是指在演化过程中由于积累各种突变而丧失功能的基因。假基因主要包含两大类,重复假基因(Duplicated pseudogene,又称unprocessed pseudogene)和逆转录假基因(Retroposed pseudogene,又称processed pseudogene)。重复假基因通过DNA水平重复产生;逆转录假基因通过RNA水平的重复即逆转录产生。假基因数量巨大,占已注释人类基因模型的1/4。
CellPress:
HBBP1在红细胞生成和β地中海贫血中有怎样的参与?
余佳研究员:
HBBP1通过与红系发育关键转录因子TAL1 mRNA竞争性结合RNA结合蛋白hnRNPA1,促进TAL1 mRNA稳定性,提高TAL1蛋白表达,维持了红细胞的正常发育。HBBP1的缺失会导致胚胎干细胞向红系分化能力的完全丧失,也会抑制造血干/祖细胞体内、体外红细胞的分化进程。
β-地中海贫血是一类由于β-珠蛋白基因突变或缺失而引起的溶血性贫血,激活在成体期已经沉默的胎儿血红蛋白(Fetal hemoglobin, HbF)可以有效缓解症状。HBBP1在β-地中海贫血患者中会代偿性升高,通过促进TAL1表达参与患者体内HbF活化及贫血症状缓解。
CellPress:
HBBP1/TAL1是如何减轻地中海贫血患者症状的?
余佳研究员:
已知文献(Nucleic Acids Res 2014. 42, 4283-4293;Nat Commun 2015. 6, 7085)报道TAL1可通过促进γ-globin基因区域的染色质互作参与β-地中海贫血患者中胎儿血红蛋白(HbF)活化;因此我们认为HBBP1在β-地中海贫血患者中的代偿性升高,促进了TAL1表达,进而推动了患者体内HbF活化及贫血症状的缓解。当然HBBP1也可能通过其它方式减轻地中海贫血患者症状,这个还需要进一步的深入研究。
CellPress:
与逆转录假基因相比,为什么重复的假基因通常结合RBP,而不是结合miRNA?
余佳研究员:
假基因主要的作用方式有三大类,结合miRNA、RBP或者反义转录。两类假基因起源突变机制的不同导致发挥这三种功能的可能性不同。逆转录假基因是RNA水平的重复,通过逆转录实现。逆转录常以polyA尾为引物启动因而保留了祖先拷贝的3’端miRNA结合位点,所以会更多比例结合miRNA;同时此类基因丧失了操纵子,经常也可以编码反义转录本。相比之下,重复假基因由于经过DNA水平重复产生,重复过程可能丢失3’端,导致通过祖先序列的继承而结合miRNA的可能性下降;相当部分重复假基因能保留祖先操纵子,导致其通过反义转录本发挥功能的可能性也下降。在这两种可能性下降的情况下,基因组中生存下来的重复假基因与逆转录假基因相比会更多地与RBP结合。
CellPress:
功能性假基因的发现对未来基因研究有怎样的启示?
余佳研究员:
假基因传统上被认为是无功能的,功能性假基因HBBP1的重新发现有三个方面的启示。首先,我们在进行各个物种基因组水平的功能筛选时,假基因不应该被排除在外。事实上,由于假基因数量众多,假基因的演化、功能、调控机制需要被关注。其次考虑到通过重复产生的若干人类特异蛋白编码基因已被证明参与塑造人类特有的生物学特征,同样是通过重复产生的数量庞大的假基因,是否有一定比例在人类特异的生物学特征(特别是不像脑扩张的不太明显的性状)塑造中发挥作用,值得思考和研究。最后,HBBP1能发挥如此重要的功能再次说明了生物体包括我们自身的遗传或发育网络具有很强的可演化能力;这意味着以模式物种为核心体系推动的生命科学研究中需要更多地考虑各物种自身的特异性。
CellPress:
您和您的团队在接下来的研究重点将聚焦在哪些方面?
余佳研究员:
我们将继续关注假基因的功能及进化意义。研究重点将聚焦在以下方面:1)考虑到目前分析显示假基因特异高表达于骨髓组织,在基因组水平研究假基因在造血发育中的功能,及在相关疾病中的潜在作用;2)继续揭示一系列通过RBP decoy发挥作用的重复假基因的生理功能;3)发现和揭示假基因新的作用机制及进化途径;4)研究假基因在人类特异性状维持中的作用以及这些性状在自然演化中的适应性意义。

作者简介

余佳
研究员
余佳,北京协和医学院长聘教授(首批)、中国医学科学院基础医学研究所与医学分子生物学国家重点实验室研究员,中国医学科学院RNA与造血调控研究重点实验室主任,是国家杰出青年科学基金获得者,教育部长江学者奖励计划入选者(青年),人社部百千万人才工程国家级人选,科技部重点研发专项首席科学家。研究方向聚焦“RNA代谢与细胞命运调控”,在造血发育、干细胞定向分化及肿瘤发生领域取得一系列原创成果,作为通讯作者(含共同)在Cell Stem Cell、Developmental Cell、Cell Res、Nat. Commun (2017, 2019)、EMBO J (2015,2020)、Genome Res、Autophagy、Nucleic Acids Res(2013, 2014, 2017, 2020)、Cancer Res (2010, 2015, 2020)发表多篇论文,被引用3000余次。

张勇
研究员
张勇,1997-2006年于北大生命科学学院获学士、博士学位,后从事博士后研究并被聘为Senior bioinformatician,2011年加入中科院动物所,获基金委优秀青年科学基金项目支持。他开发了一个新方法在基因组水平大规模鉴定物种特异的新基因。基于这些方法的创新,他以人、果蝇等动物体系为主要研究对象,围绕物种特异新基因产生的突变机制和分子功能等方面开展了较深入的系统研究。例如,他发现了新基因可起源于逆转座子介导的基因重复过程及新基因在人脑扩张等表型演化中的普遍作用。这些工作在Genome Research等知名期刊发表。更多细节,请参见网页,http://zhanglab.ioz.ac.cn/publication。

石莉红
研究员
石莉红,中国医学科学院血液病医院(中国医学科学院血液学研究所),实验血液学国家重点实验室,研究员、博士生导师,北京协和医学院“协和学者特聘教授”。2008年毕业于中国科学院动物研究所,干细胞与生殖生物学国家重点实验室,获生理学博士学位,之后在美国密歇根大学医学院从事博士后研究,2014年回国并加入实验血液学国家重点实验室。研究方向主要包括:人多能干细胞(hESCs或iPSC)及造血干/祖细胞向红系定向分化的调控机制研究和红细胞疾病的发病机理研究。在Nature Medicine、Cell Stem Cell、Nature Communications、Blood、PNAS、Nucleic Acids Research、Bioinformatis等国际权威杂志发表SCI文章40余篇,主持包括科技部干细胞重点研发项目、国自然面上项目、中国医学科学院创新工程、天津市面上项目在内的多个科研项目。

马艳妮
副研究员
马艳妮,中国医学科学院基础医学研究所副研究员,硕士生导师。2008年7月毕业于中国医学科学院基础医学研究所生化与分子生物学系,理学博士。作为负责人承担国家自然科学基金委青年基金项目、面上项目,作为科研骨干参与科技部973项目,国家重点研发计划。获北京市“科技新星”(2017)、“协和新星” (2015)等人才计划支持。作为第一作者或通讯作者(含共同)在Cell Stem Cell、Developmental Cell、EMBO J (2015, 2020)、Genome Research、Nature Communications、Mol Cell Bio等国际学术期刊发表多篇研究论文。
相关论文信息
研究成果发表在Cell Press旗下Developmental Cell期刊上,点击“阅读全文”或扫描下方二维码查看论文。
▌论文标题:
Genome-wide analysis of pseudogenes reveals HBBP1’s human-specific essentiality in erythropoiesis and implication in b-thalassemia
▌论文网址:
https://www.cell.com/developmental-cell/fulltext/S1534-5807(20)31025-X
▌DOI:
https://doi.org/10.1016/j.devcel.2020.12.019
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




