- +1
科学家发现,衰老细胞诱导巨噬细胞产生的CD38消耗了NAD+
原创 代丝雨 奇点网 收录于话题#衰老,啊,衰老17个
说起这几年最火的抗衰老元素,那非NAD+莫属——当然,这其中有部分要“归功于”天价却一瓶难求的保健品NMN。
NAD+,也就是烟酰胺腺嘌呤二核苷酸,是一种氧化还原辅酶,与能量代谢密切相关,在很多研究中都有发现,随着年龄的增长,NAD+水平会逐渐降低,而恢复NAD+水平有助于缓解年龄相关的功能障碍。
所以补充NAD+就成了抗衰老的大热门。
我们现在对NAD+到底是怎么来的已经了解得比较透彻了,NMN正是诸多NAD+前体中的性价比之选。但是,NAD+为什么会随着年龄增长消失呢?
近期,《自然·代谢》杂志同期发表了两篇论文,为我们揭开了NAD+消失之谜。原来,在衰老组织中,由衰老细胞导致的慢性炎症会诱导M1巨噬细胞中的CD38表达,而CD38正是减少NAD+合成、促进NAD+降解的关键。
通过senolytics药物消除衰老细胞,则能显著提升NAD+水平。
看来我们又找到了一个新的抗衰老靶点,CD38!
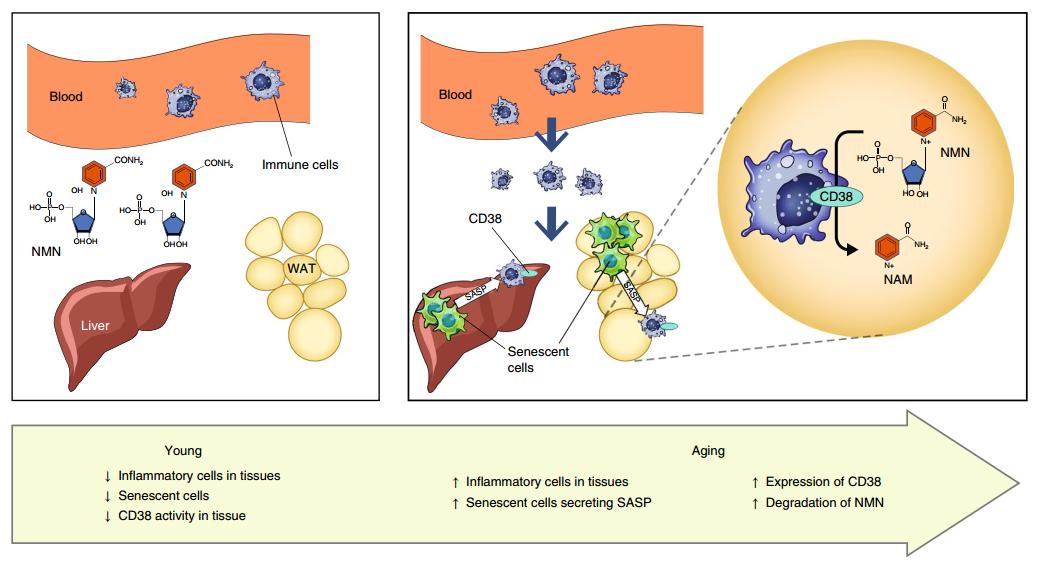
其实之前就有科学家发现,CD38的表达与NAD+水平存在相关性,不过其中有一个令人百思不得其解的问题:大部分CD38位于细胞膜,它的催化位点朝向细胞膜外,而NAD+则主要存在于细胞内部,CD38到底是怎么影响NAD+水平的呢?这个问题被科学家们称作“CD38的拓扑悖论”。
另一方面,CD38主要表达于免疫细胞中,而众所周知,衰老会带来广泛的慢性炎症,炎性反应很可能会激活免疫细胞,导致衰老组织中CD38的积累。
研究者对小鼠的组织进行了分析,发现在衰老动物的肝脏和白色脂肪组织中,出现了大量的CD38富集,而这些CD38主要来源于促炎的M1巨噬细胞。
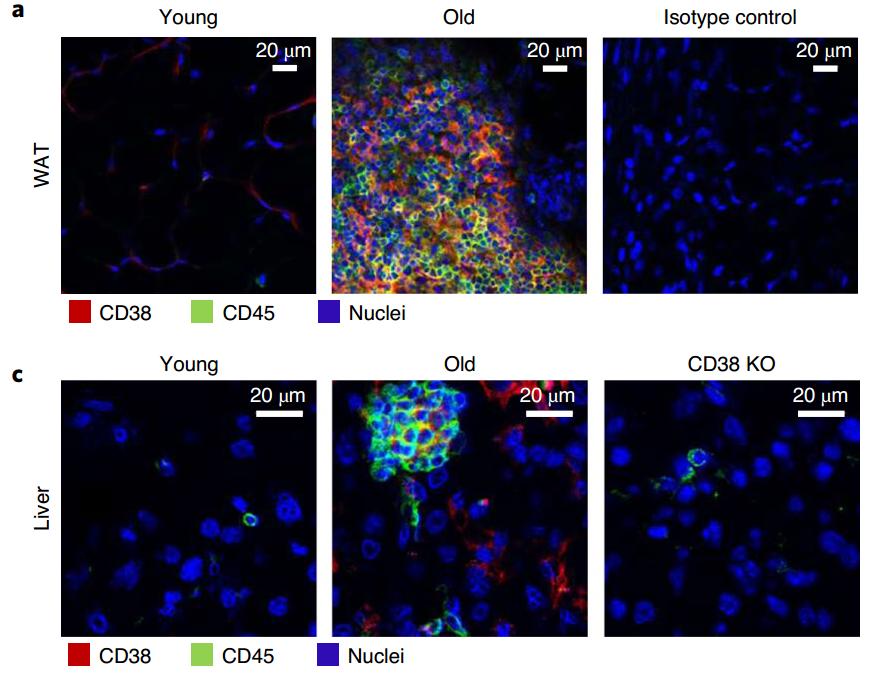
衰老组织中存在大量的CD38
当研究者尝试通过脂多糖(LPS)诱导炎症表型,果然发现了CD38+炎性细胞浸润白色脂肪组织,并导致了NAD+和它的前体NMN水平的下降。如果提前敲除CD38基因,则不会导致NAD+水平的变化。
同时,将衰老细胞和巨噬细胞共同培养,则能够显著提升CD38的表达和活性。通过药物抑制衰老细胞相关分泌表型(SASP),则能够在体内降低组织内的CD38水平,并逆转NAD+水平的下降。
由此可见,是细胞的衰老诱导了CD38+巨噬细胞的浸润和CD38表达的增加,并导致了后续NAD+的减少。
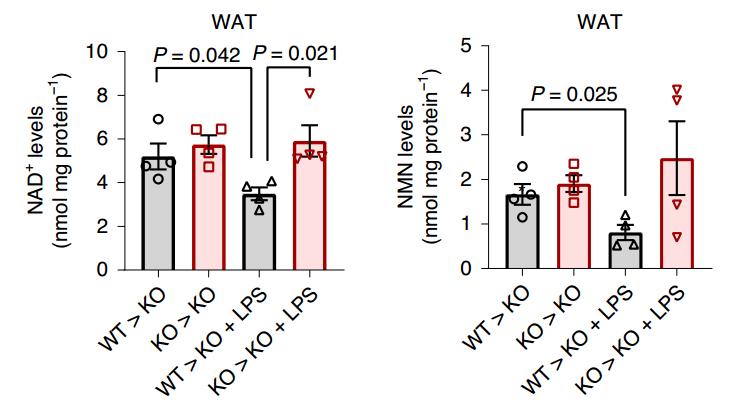
LPS可诱导CD38依赖性的NAD+/NMN水平降低
那么CD38是如何让NAD+减少的呢?
正如前文所述,CD38的催化结构与NAD+身处“两个空间”,很显然它并不主要直接作用于NAD+,所以研究者们猜测,CD38很可能是与胞外的NAD+前体们存在一些关系,使得NAD+的生物合成减少。
有趣的是,实验结果显示,在细胞内存在的少量CD38已经足以调节胞内NAD+的水平,而CD38同时还作用于胞外的NMN,阻止细胞对NMN的利用,而且这种作用仅与NMN有关,不影响其他的NAD+前体。
使用CD38抗体治疗,则可以将老年小鼠白色脂肪组织内的NAD+水平提升到与年轻小鼠类似的水平,简直非常神奇。如果同时补充NMN,NAD+水平还能够得到进一步的改善。
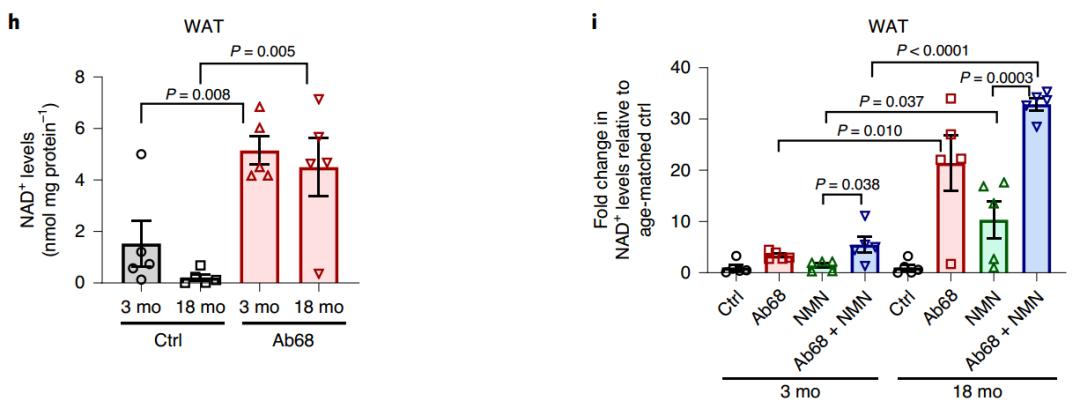
CD38抗体和补充NMN可以提升年老小鼠NAD+水平
当然了,根据数据,CD38并不是唯一的调控NAD+水平的通路,不过从目前来看,它是很有潜力的一个“治疗衰老”的靶点~
参考资料:
[1]https://www.nature.com/articles/s42255-020-00292-5
[2] http://doi.org/10.1038/s42255-020-00305-3
[3] http://doi.org/10.1038/s42255-020-00298-z本文作者 | 代丝雨
原标题:《两篇《自然·代谢》:破解抗衰老分子NAD+消失之谜!科学家发现,衰老细胞诱导巨噬细胞产生的CD38消耗了NAD+丨科学大发现》
本文为澎湃号作者或机构在澎湃新闻上传并发布,仅代表该作者或机构观点,不代表澎湃新闻的观点或立场,澎湃新闻仅提供信息发布平台。申请澎湃号请用电脑访问http://renzheng.thepaper.cn。





- 报料热线: 021-962866
- 报料邮箱: news@thepaper.cn
互联网新闻信息服务许可证:31120170006
增值电信业务经营许可证:沪B2-2017116
© 2014-2024 上海东方报业有限公司




